题目内容
11.在一定条件下发生下列反应,其中属于盐类水解反应的是( )| A. | Cl2+H2O?H++Cl-+HClO | B. | HCO3-+H2O?H3O++CO32- | ||
| C. | H2S?H++HS- | D. | NH4++2H2O?NH3•H2O+H3O+ |
分析 在盐中有弱酸根离子或弱碱离子时,与水电离产生的氢离子或氢氧根离子结合生成弱电解质,促进水的电离平衡正向进行,溶液显示酸碱性,则发生的反应为盐类的水解反应.
解答 解:A.氯气为单质,Cl2+H2O?H++Cl-+HClO是氯气和水发生的化学反应,不属于水解反应,故A错误;
B.碳酸氢根离子水解生成碳酸,而HCO3-+H2O?H3O++CO32-为电离反应,故B错误;
C.反应中没有水参加反应,则不属于水解反应,HS-水解生成H2S和OH-,H2S?HS-+H+是弱电解质电离方程式,故C错误;
D.铵根离子为弱碱离子,结合水电离产生的OH-,水解反应为NH4++2H2O?NH3•H2O+H3O+,是水解反应,氢离子写成了水合氢离子的形式,故D正确;
故选D.
点评 本题考查水解的原理,明确盐中的构成及“有弱才水解的规律”即可解答,注意离子结合水电离产生的氢离子或氢氧根离子结合生成弱电解质是解答的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列气体中,不能用排水法收集的是( )
| A. | NO | B. | CO | C. | NO2 | D. | O2 |
2.甲乙两烧杯中分别为等体积,等物质的量浓度的稀盐酸及氢氧化钠溶液,在甲乙两烧杯中分别加入少量等质量的铝粉(酸碱均过量),充分反应后,甲乙两烧杯中产生氢气的体积(同温同压下测定)之比 为( )
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 2:1 |
19.下列化学用语的表达正确的是( )
| A. | KCl电离方程式:KCl=K++Cl- | B. | 光导纤维主要成分的化学式:Si | ||
| C. | 中子数为20的氯原子:1720Cl | D. | S2-的结构示意图: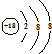 |
6.在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1mol PbO2反应所需Cr3+的物质的量为( )
| A. | 0.75 mol | B. | 1.5 mol | C. | 1.0 mol | D. | 0.67 mol |
16.下列离子组合,能够大量共存的是( )
| A. | 酸性溶液中:Al3+、Fe3+、SO42-、SCN- | |
| B. | 透明溶液中:MnO4-、K+、Na+、NO3- | |
| C. | 强碱性溶液中:Na+、NO3-、HCO3-、SO32- | |
| D. | 强酸性溶液中:Na+、Fe2+、SO42-、NO3- |
3.一定条件下,在体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是( )
| A. | 其它条件不变,若升高温度,X的体积分数增大,则该反应的正反应△H>0 | |
| B. | 其它条件不变,将容器体积变为20L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 其它条件不变,若增大压强,则物质Y的转化率减小 | |
| D. | 以X浓度变化表示的反应速率为0.001mol•L-1•s-1 |
20.一定温度下,取pH=12的NaOH溶液和氨水各10mL,分别用蒸馏水冲稀至1L.关于稀释后的溶液的pH的说法正确的是( )
| A. | NaOH溶液的pH小于氨水的pH | B. | NaOH溶液的pH大于氨水的pH | ||
| C. | 两溶液的pH相等 | D. | 无法判别两溶液pH的相对大小 |
19.海水开发利用的部分过程如图所示.下列说法错误的是( )
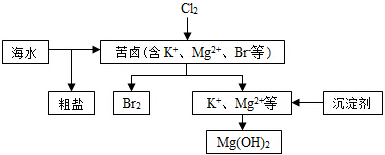

| A. | 向苦卤中通入Cl2,目的是为了提取溴 | |
| B. | 除去粗盐中的SO42-杂质,可以选择BaCl2等试剂 | |
| C. | 工业生产常选用Ca(OH)2作为沉淀剂 | |
| D. | 电解法制取金属镁时,原料一般是灼烧Mg (OH)2得到的MgO |