题目内容
 元素X基态原子的p电子比s电子少1个.元素Y基态原子的2p电子是2s电子的2倍.元素Z的一种单质为自然界硬度最大的物质.元素M位于第四周期,其基态原子失去3个电子后3d轨道半满.
元素X基态原子的p电子比s电子少1个.元素Y基态原子的2p电子是2s电子的2倍.元素Z的一种单质为自然界硬度最大的物质.元素M位于第四周期,其基态原子失去3个电子后3d轨道半满.(1)X、Y、Z的基态原子,第一电离能由大到小的顺序是
(2)X的氢化物易于液化,其原因是
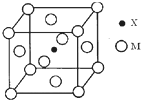
(3)X与M形成的一种化合物晶胞结构如图所示.
①每个晶胞中M离子的数目为
②该化合物的化学式为
(4)Y可形成单质Y3
①Y3分子的空间构型为
②写出一种与Y3互为等电子体的分子的化学式:
(5)Y、Z的化合物ZY可与M的单质生成配合物M(ZY)5,该配合物中σ键与π键的个数比为
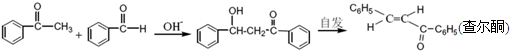
苯亚甲基苯乙酮俗称查尔酮,淡黄色棱状晶体,熔点58℃,沸点208℃(3.3kPa)易溶于醚、氯仿和苯,微溶于醇.制备原理如下:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:元素X基态原子的p电子比s电子少1个,则X为氮元素,元素Y基态原子的2p电子是2s电子的2倍,则Y为氧元素,元素Z的一种单质为自然界硬度最大的物质,则Z为碳元素,元素M位于第四周期,其基态原子失去3个电子后3d轨道半满,则M为铁元素,据此答题.
解答:
解:元素X基态原子的p电子比s电子少1个,则X为氮元素,元素Y基态原子的2p电子是2s电子的2倍,则Y为氧元素,元素Z的一种单质为自然界硬度最大的物质,则Z为碳元素,元素M位于第四周期,其基态原子失去3个电子后3d轨道半满,则M为铁元素,
(1)由于氮原子的最外层p轨道电子处于半满状态,是一种稳定结构,所以氮的第一电离能高于相邻同周期元素,其它主族元素非金属性越强,第一电离能越大,所以X、Y、Z的第一电离能由大到小的顺序为N>O>C,
故答案为:N>O>C;
(2)由于氨分子之间有氢键的存在,所以氨气易液化,
故答案为:氨分子间形成氢键;
(3)根据均摊法可知,在每个晶胞中含有铁离子数为8×
+6×
=4,氮离子数为1,所以该化合物的化学式为Fe4N,
故答案为:4;Fe4N;
(4)①O3分子中,中心氧原子的价层电子对数为,
=3,中心氧原子周围有2个δ键,所以O3的空间构型为V型(或折线型),
故答案为:V型(或折线型);
②根据等电子体的定义可知,与O3互为等电子体的分子为SO2,故答案为:SO2;
(5)在配合物Fe(CO)5中,含有5个配位键,都是σ键,每个CO中有2个π键和1σ键,所以该配合物中σ键与π键的个数比为(5+5):10=1:1,
故答案为:1:1.
(1)由于氮原子的最外层p轨道电子处于半满状态,是一种稳定结构,所以氮的第一电离能高于相邻同周期元素,其它主族元素非金属性越强,第一电离能越大,所以X、Y、Z的第一电离能由大到小的顺序为N>O>C,
故答案为:N>O>C;
(2)由于氨分子之间有氢键的存在,所以氨气易液化,
故答案为:氨分子间形成氢键;
(3)根据均摊法可知,在每个晶胞中含有铁离子数为8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:4;Fe4N;
(4)①O3分子中,中心氧原子的价层电子对数为,
| 6+0 |
| 2 |
故答案为:V型(或折线型);
②根据等电子体的定义可知,与O3互为等电子体的分子为SO2,故答案为:SO2;
(5)在配合物Fe(CO)5中,含有5个配位键,都是σ键,每个CO中有2个π键和1σ键,所以该配合物中σ键与π键的个数比为(5+5):10=1:1,
故答案为:1:1.
点评:本题主要考查了元素周期律、晶胞的计算、等电子体、配合物,中等难度,有一定的综合性,元素推断是解题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是( )
| A、未洗涤烧杯和玻璃棒 |
| B、转移溶液前溶液未冷却至室温 |
| C、容量瓶未干燥 |
| D、定容时俯视液面 |
在25℃时,某稀溶液中由水电离产生的c(H+)=10-13mol/L.有关该溶液的叙述正确的是( )
| A、该溶液的pH值可能为1 |
| B、水的电离受到促进 |
| C、水的离子积将变小 |
| D、该溶液的pH值一定为13 |
取一定量CuO粉末与0.5L稀硫酸充分反应后,将一根50g铁棒插入上述溶液中,至铁棒质量不再变化时,铁棒增重0.24g,并收集到224mL H2(标准状况).由此推知CuO粉末的质量为( )
| A、1.92g | B、2.4g |
| C、6.4g | D、8g |
下列各组烃的混合物,只要总质量一定,按任意比例混合,完全燃烧后生成的CO2和H2O都是恒量的是( )
| A、C2H2、C2H4 |
| B、C2H4、C4H6 |
| C、C2H6、C3H6 |
| D、C6H6、C2H2 |
用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,44gCO2气体中含有的原子数为3NA |
| B、常温常压下,11.2 L 氯化氢气体中含有的分子数为0.5NA |
| C、1 mol铁与足量的稀硫酸完全反应转移的电子数为3NA |
| D、1 L 1 mol?L-1 CuCl2溶液中含有的氯离子数为NA |