题目内容
根据要求回答下列问题:
(1)标准状况下,①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3中,含分子数最多的是(填写序号,下同) ,含原子数最多的是 ,体积最小的是 .
(2)100mL含0.27g Al3+的Al2(SO4)3溶液中的SO42-的物质的量浓度是 mol?L-1.
(1)标准状况下,①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3中,含分子数最多的是(填写序号,下同)
(2)100mL含0.27g Al3+的Al2(SO4)3溶液中的SO42-的物质的量浓度是
考点:物质分子中的原子个数计算,物质的量浓度的相关计算
专题:阿伏加德罗常数和阿伏加德罗定律
分析:(1)根据n=
=
=
计算CH4、HCl、H2S的物质的量,由N=nNA可知,物质的量越大,含有分子数目越多,结合每个分子含有原子数目计算各物质含有原子物质的量,进而比较原子数目多少,根据V=nVm计算HCl、H2S、NH3体积,进而比较体积大小;
(2)根据n=
计算Al3+的物质的量,利用n(Al3+):n(SO42-)=2:3计算100mL溶液中n(SO42-),进而根据c=
计算SO42-物质的量浓度.
| V |
| Vm |
| N |
| NA |
| m |
| M |
(2)根据n=
| m |
| M |
| n |
| V |
解答:
解:(1)标准状况下,①6.72LCH4的物质的量为
=0.3mol,含有原子为0.3mol×5=1.5mol;
②3.01×1023个HCl的物质的量为
=0.5mol,含有原子为0.5mol×2=1mol,体积为0.5mol×22.4L/mol=11.2L;
③13.6gH2S的物质的量为
=0.4mol,含有原子为0.4mol×3=1.2mol,体积为0.4mol×22.4L/mol=8.96L;
④0.2molNH3含有原子为0.2mol×4=0.8mol,体积为0.2mol×22.4L/mol=4.48L,
故所含分子数最多的是②,含有原子数最多的是①,体积最小的是④;
故答案为:②;①;④.
(2)0.27gAl3+的物质的量=
=0.01mol,n(Al3+):n(SO42-)=2:3,则n(SO42-)=0.015mol,SO42-的物质的量浓度故c[Al2(SO4)3]=
=0.15mol/L;
故答案为:0.15.
| 6.72L |
| 22.4L/mol |
②3.01×1023个HCl的物质的量为
| 3.01×1023 |
| 6.02×1023mol-1 |
③13.6gH2S的物质的量为
| 13.6g |
| 34g/mol |
④0.2molNH3含有原子为0.2mol×4=0.8mol,体积为0.2mol×22.4L/mol=4.48L,
故所含分子数最多的是②,含有原子数最多的是①,体积最小的是④;
故答案为:②;①;④.
(2)0.27gAl3+的物质的量=
| 0.27g |
| 27g/mol |
| 0.015mol |
| 0.1L |
故答案为:0.15.
点评:本题考查物质的量的有关计算,比较基础,注意对公式的理解与灵活运用.

练习册系列答案
相关题目
下列反应不能通过一步反应直接完成的是( )
| A、Na2CO3→NaHCO3 |
| B、SiO2→Na2SiO3 |
| C、Al2O3→Al(OH)3 |
| D、Fe(OH)2→Fe(OH)3 |
下列各种应用中,利用了硅元素的还原性的是( )
| A、用硅制造集成电路、晶体管等半导体器件 | ||||
| B、在野外,用硅、石灰、烧碱的混合物制取氢气:Si+Ca (OH)2+2NaOH=Na2SiO3+CaO+2H2↑ | ||||
| C、用HF酸刻蚀玻璃:SiO2+4HF=SiF4↑+2H2O | ||||
D、单质硅的制备:SiO2+2C
|
常温下,若溶液中由水电离产生的c(H+)=1×10-13mol?L-1,满足此条件的溶液中一定不可以大量共存的离子组是( )
| A、Na+、Al3+、NO3-、SO42- |
| B、K+、Na+、Cl-、HCO3- |
| C、K+、Na+、Cl-、S2- |
| D、K+、NH4+、SO42-、NO3- |
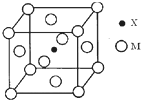 元素X基态原子的p电子比s电子少1个.元素Y基态原子的2p电子是2s电子的2倍.元素Z的一种单质为自然界硬度最大的物质.元素M位于第四周期,其基态原子失去3个电子后3d轨道半满.
元素X基态原子的p电子比s电子少1个.元素Y基态原子的2p电子是2s电子的2倍.元素Z的一种单质为自然界硬度最大的物质.元素M位于第四周期,其基态原子失去3个电子后3d轨道半满.