题目内容
7.金属钠与下列溶液反应时,既有白色沉淀析出又有气体逸出的是( )| A. | BaCl2溶液 | B. | K2SO4溶液 | C. | FeCl3溶液 | D. | Ca(HCO3)2溶液 |
分析 根据钠的化学性质:与水、酸、盐溶液的反应,利用2Na+2H2O=2NaOH+H2↑,根据生成的氢氧化钠与选项中物质的反应判断反应现象.
解答 解:A、钠能与溶液中的水反应2Na+2H2O=2NaOH+H2↑,有气体产生,氢氧化钠不与氯化钡反应,没有沉淀生成,故A错误;
B、钠与水反应2Na+2H2O=2NaOH+H2↑,有气体生成,氢氧化钠与K2SO4不反应,故B错误;
C、钠能与溶液中的水反应2Na+2H2O=2NaOH+H2↑,有气体产生,同时氢氧化钠与氯化铁反应生成红褐色沉淀,没有白色沉淀生成,故C错误;
D、钠首先与水反应生成氢氧化钠和氢气,然后氢氧化钠与Ca(HCO3)2反应生成碳酸钙白色的沉淀,故D正确.
故选D.
点评 本题考查元素化合物的性质,比较简单,钠与碱、盐的反应中首先考虑与溶液中的水反应,然后再看生成的氢氧化钠能否与碱、盐本身反应.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
14.已知硅酸盐中,通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.Si2O44-四面体可用图(a)表示.图(b)是一种无限长单链结构的多硅酸根,其化学式为( )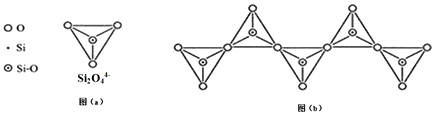

| A. | Si2O76- | B. | Si2O52- | C. | SiO32- | D. | Si4O116- |
15.下列对主要实验现象描述和结论的判断都正确的是( )
| 选项 | 实验操作 | 主要现象 | 结论 |
| A | 将在酒精灯灼烧后的铜丝迅速插入无水乙醇中 | 铜丝变黑 | CH3CH2OH发生氧化反应生成CH3COOH,铜丝起催化作用 |
| B | 分别在苯和乙醇中滴加酸性高锰酸钾溶液 | 紫红色都褪去 | 苯和乙醇都有还原性 |
| C | 分别在水、乙醇中 加入钠粒 | 都产生气体 | 产生的气体为氢气 |
| D | 将酒精在空气中点燃 | 产生无色火焰 | 酒精发生氧化反应 |
| A. | A | B. | B | C. | C | D. | D |
15.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义.以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:
N2(g)+3H2(g)?2NH3(g)△H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol.则前5分钟的平均反应速率v(N2)=0.01mol/(L•min).平衡时H2的转化率为50%
(2)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①试比较K1、K2的大小,K1>K2(填“<”“>”或“=”);
②下列各项能作为判断该反应达到化学平衡状态的依据是C(填序号字母)
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B.v(H2)正=3v(H2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃,当测得NH3、N2和H2物质的量分别为3mol、2mol和 1mol时,则v(N2)正>v(N2)逆
(填“<”“>”或“=”)
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:
N2(g)+3H2(g)?2NH3(g)△H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol.则前5分钟的平均反应速率v(N2)=0.01mol/(L•min).平衡时H2的转化率为50%
(2)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如表所示:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K3 | 0.5 |
①试比较K1、K2的大小,K1>K2(填“<”“>”或“=”);
②下列各项能作为判断该反应达到化学平衡状态的依据是C(填序号字母)
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B.v(H2)正=3v(H2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃,当测得NH3、N2和H2物质的量分别为3mol、2mol和 1mol时,则v(N2)正>v(N2)逆
(填“<”“>”或“=”)
12.化学与生活、生产密切相关.下列有关说法正确的是( )
| A. | 食用醋中含有30%左右的乙酸 | |
| B. | 肥皂在碱性条件下水解可得甘油 | |
| C. | 为增加肥效,将草木灰与铵态氮肥混合施用 | |
| D. | 用pH试纸可检验食盐与假盐(NaNO2) |
19.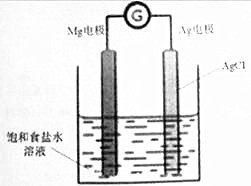 Mg/AgCl电池是一种化学电源,以镁和表面镀氯化银的银为电极,饱和食盐水为电解液,如图所示,发生的反应方程式为Mg+2AgCl=MgCl2+2Ag,下列说法正确的是( )
Mg/AgCl电池是一种化学电源,以镁和表面镀氯化银的银为电极,饱和食盐水为电解液,如图所示,发生的反应方程式为Mg+2AgCl=MgCl2+2Ag,下列说法正确的是( )
 Mg/AgCl电池是一种化学电源,以镁和表面镀氯化银的银为电极,饱和食盐水为电解液,如图所示,发生的反应方程式为Mg+2AgCl=MgCl2+2Ag,下列说法正确的是( )
Mg/AgCl电池是一种化学电源,以镁和表面镀氯化银的银为电极,饱和食盐水为电解液,如图所示,发生的反应方程式为Mg+2AgCl=MgCl2+2Ag,下列说法正确的是( )| A. | 镁电极上发生还原反应 | |
| B. | 银电极的电极反应式:AgCl+e-=Ag+Cl- | |
| C. | 该装置中能最转化方式为电能转化为化学能 | |
| D. | 电池工作时,钠离子移向镁电极,氯离子移向银电极 |
16.下列叙述正确的是( )
| A. | 标准状况下,1mol H2O的体积约为22.4 L | |
| B. | 1 mol气体的体积若是22.4 L,它必定处于标准状况 | |
| C. | 20℃、101 kPa时1mol HCl所占的体积约为22.4 L | |
| D. | 标准状况下,1 mol H2和O2的混合气体的体积约为22.4 L |