题目内容
19.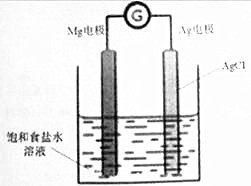 Mg/AgCl电池是一种化学电源,以镁和表面镀氯化银的银为电极,饱和食盐水为电解液,如图所示,发生的反应方程式为Mg+2AgCl=MgCl2+2Ag,下列说法正确的是( )
Mg/AgCl电池是一种化学电源,以镁和表面镀氯化银的银为电极,饱和食盐水为电解液,如图所示,发生的反应方程式为Mg+2AgCl=MgCl2+2Ag,下列说法正确的是( )| A. | 镁电极上发生还原反应 | |
| B. | 银电极的电极反应式:AgCl+e-=Ag+Cl- | |
| C. | 该装置中能最转化方式为电能转化为化学能 | |
| D. | 电池工作时,钠离子移向镁电极,氯离子移向银电极 |
分析 根据电池反应式知,Mg失电子发生氧化反应作负极,负极反应式为Mg-2e-=Mg2+,正极上电极反应式为2AgCl+2e-=2Ag+2Cl-,放电时阴离子向负极移动、阳离子向正极移动,以此解答该题.
解答 解:A.根据电池反应式知,Mg失电子发生氧化反应作负极,故A错误;
B.根据电池反应式中,Ag元素化合价由+1价变为0价,发生还原反应,所以银电极的电极反应式:AgCl+e-=Ag+Cl-,故B正确;
C.Mg/AgCl电池是一种化学电源,转化方式为化学能转化为电能,故C错误;
D.电池工作时,钠离子移向正极银电极,氯离子移向负极镁电极,故D错误.
故选B.
点评 本题考查了原电池原理,为高频考点,侧重于学生的分析能力的考查,根据元素化合价确定正负极,再结合离子移动方向、原电池构成条件分析解答,题目难度不大.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案
相关题目
7.金属钠与下列溶液反应时,既有白色沉淀析出又有气体逸出的是( )
| A. | BaCl2溶液 | B. | K2SO4溶液 | C. | FeCl3溶液 | D. | Ca(HCO3)2溶液 |
14.元素周期律和元素周期表是学习化学的重要工具,下列说法不正确的是( )
| A. | HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱 | |
| B. | 形成离子键的阴阳离子间只存在静电吸引力 | |
| C. | ⅠA金属元素是同周期中金属性最强的元素 | |
| D. | P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 |
4.有15g A物质与10.5g B物质恰好完全反应,生成7.2g C物质、1.8g D物质和0.3molE物质.则E的摩尔质量是( )
| A. | 27.5 g•mol-1 | B. | 55 g•mol-1 | C. | 100 g•mol-1 | D. | 111 g•mol-1 |
11.设NA为阿伏加德罗常数值,下列有关叙述正确的是( )
| A. | 高温、高压、催化剂条件下,足量N2与3 mol H2充分反应,共断裂H-H键3NA | |
| B. | 46 g Na与0.5 L 2 mol•L-1盐酸充分反应,转移电子数为2NA | |
| C. | 8.4 g固体NaHCO3中,含有阳离子0.2NA | |
| D. | 标准状况下,2.24 L CCl4含有的共价键数为0.4NA |




 氧化还原反应与生产、生活、科技密切相关,请回答下列问题:
氧化还原反应与生产、生活、科技密切相关,请回答下列问题: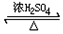 CH3COOC2H5+H2O;该反应的有机反应类型是取代(酯化)反应.
CH3COOC2H5+H2O;该反应的有机反应类型是取代(酯化)反应.