题目内容
20. 元素在周期表中的位置,反映了元素的原子结构和元素性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素性质.如图是元素周期表的一部分.(1)阴影部分元素N在元素周期表中的位置为第二周期VA族.
(2)N元素的氢化物与其最高价氧化物反应的产物的化学式为NH4NO3,该物质中含有化学键有离子键、共价键.
(3)根据元素周期律及相关知识,请你完成以下填空:
①PH3与AsH3的稳定性:PH3>AsH3
②H3AsO4、H3PO4、的酸性强弱:H3AsO4< H3PO4(用“>”、“<”或“=”表示).
(4)NH3的沸点比PH3的高,其原因为NH3分子间存在氢键.
分析 (1)由图可知,N位于第二周期第VA族;
(2)N元素的氢化物与其最高价氧化物反应生成硝酸铵;
(3)①元素非金属性越强,其气态氢化物越稳定;
②元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(4)分子晶体的沸点与其相对分子质量成正比,但含有氢键的物质其沸点较高.
解答 解:(1)由图可知,阴影部分元素N在元素周期表中的位置为第二周期VA族,
故答案为:二;VA;
(2)N元素的氢化物与其最高价氧化物反应生成硝酸铵,化学式为NH4NO3,含离子键、共价键,
故答案为:NH4NO3;离子键、共价键;
(3)①元素非金属性P>As,则PH3与AsH3的稳定性:PH3>AsH3,故答案为:>;
②元素的非金属性P>As,H3AsO4、H3PO4的酸性强弱:H3AsO4<H3PO4,故答案为:<;
(4)NH3的沸点比PH3的高,其原因为NH3分子间存在氢键,故答案为:NH3分子间存在氢键.
点评 本题考查位置、结构及性质的应用,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意含氢键的物质及性质,题目难度不大.

练习册系列答案
相关题目
5.如图是MgSO4、NaCl的溶解度曲线.下列说法正确的是( )


| A. | MgSO4的溶解度随温度升高而升高 | |
| B. | NaCl的溶解度比MgSO4的溶解度大 | |
| C. | 在t2℃时,MgSO4饱和溶液的溶质质量分数最大 | |
| D. | 把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出 |
12.已知在25℃、101kPa下,1g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反应的热化学方程式正确的是( )
| A. | C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(g)△H=-48.40 kJ•mol-1 | |
| B. | C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H=-5518 kJ•mol-1 | |
| C. | C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H=+5518 kJ•mol-1 | |
| D. | C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H=-48.40 kJ•mol-1 |
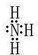 ;
; 在75℃左右,用HgSO4做催化剂,乙炔可水化为乙醛,但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种:现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制乙醛,装置如图所示,请回答下列问题;
在75℃左右,用HgSO4做催化剂,乙炔可水化为乙醛,但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种:现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制乙醛,装置如图所示,请回答下列问题;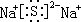 .
.