题目内容
2.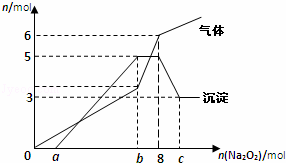 将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+的物质的量分别为( )
将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+的物质的量分别为( )| A. | 2mol、3mol、6mol | B. | 3mol、2mol、6mol | C. | 2mol、3mol、4mol | D. | 3mol、2mol、2mol |
分析 据图象中沉淀的量的变化情况可以推知镁离子的物质的量为3mol,氢氧化铝和氢氧化镁沉淀一共是5mol;
根据元素守恒,所以含有铝离子的物质的量2mol;
根据生成气体的量的增加趋势,可知生成的气体除了过氧化钠和溶液反应生成的氧气之外,还有氨根离子与氢氧根离子反应生成氨气,
图象中加入过氧化钠的物质的量在0~amol之间时,所得沉淀量为0,与溶液中的氢离子反应,结合气体的图象分析,加入8mol过氧化钠时,共生成气体6mol,由反应方程式2Na2O2+2H2O=4NaOH+O2↑可知2mol的过氧化钠生成1mol的氧气,所以8mol的过氧化钠生成4mol的氧气,则生成氨气是2mol,根据氮守恒分析解答.
解答 解:根据图象中沉淀的量的变化情况可以推知镁离子的物质的量为3mol,氢氧化铝和氢氧化镁沉淀一共是5mol;
根据元素守恒,所以含有铝离子的物质的量2mol;
根据生成气体的量的增加趋势,可知生成的气体除了过氧化钠和溶液反应生成的氧气之外,还有氨根离子与氢氧根离子反应生成氨气,
图象中加入过氧化钠的物质的量在0~amol之间时,所得沉淀量为0,与溶液中的氢离子反应,结合气体的图象分析,加入8mol过氧化钠时,共生成气体6mol,由反应方程式2Na2O2+2H2O=4NaOH+O2↑可知2mol的过氧化钠生成1mol的氧气,所以8mol的过氧化钠生成4mol的氧气,则生成氨气是2mol,所以铵根离子为2mol,则原溶液中的Mg2+、Al3+、NH4+的物质的量分别为3mol、2mol、2mol,故选D.
点评 本题是一道有关离子检验的综合知识题目,考察角度很广,难度较大.

练习册系列答案
相关题目
12. 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol•L-1NaOH溶液
(1)若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体5.0g.
(2)从图中选择称量NaOH固体所需要的仪器是(填字母):abe.
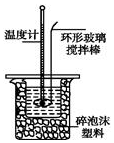
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是Cu传热快,热量损失大.
(2)在操作正确的前提下,提高中和热测定准确性的关键是减少实验过程中的热量损失.大烧杯如不盖硬纸板,求得的中和热数值将偏小(填“偏大”、“偏小”或“无影响”).结合日常生活实际该实验在保温杯中(家用产品)效果更好.
(3)写出该反应中和热的热化学方程式:(中和热为57.3kJ•mol-1)$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;.
(4)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
①表中的温度差平均值为4.0℃.
②近似认为0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=4.18J•(g•℃)-1.则中和热△H=-53.5kJ/mol(取小数点后一位).
③上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
④实验中改用60mL0.5mol/L盐酸跟50mL0.55mol•L-1氢氧化钠进行反应,与上述实验相比,所放出的热量不相等(填相等或不相等,下同),所求的中和热相等简述理由中和热是指酸跟碱发生中和反应生成1mol水所放出的热量为标准的,而与酸、碱的用量无关..
 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol•L-1NaOH溶液
(1)若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体5.0g.
(2)从图中选择称量NaOH固体所需要的仪器是(填字母):abe.
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是Cu传热快,热量损失大.
(2)在操作正确的前提下,提高中和热测定准确性的关键是减少实验过程中的热量损失.大烧杯如不盖硬纸板,求得的中和热数值将偏小(填“偏大”、“偏小”或“无影响”).结合日常生活实际该实验在保温杯中(家用产品)效果更好.
(3)写出该反应中和热的热化学方程式:(中和热为57.3kJ•mol-1)$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;.
(4)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
| 试验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.6 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=4.18J•(g•℃)-1.则中和热△H=-53.5kJ/mol(取小数点后一位).
③上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
④实验中改用60mL0.5mol/L盐酸跟50mL0.55mol•L-1氢氧化钠进行反应,与上述实验相比,所放出的热量不相等(填相等或不相等,下同),所求的中和热相等简述理由中和热是指酸跟碱发生中和反应生成1mol水所放出的热量为标准的,而与酸、碱的用量无关..
17.下列各组中的离子,能在酸性溶液中大量共存的是( )
| A. | Na+、Al3+、SO42-、Cl- | B. | Na+、Fe2+、SO42-、NO3- | ||
| C. | Al3+、Na+、Cl-、AlO2- | D. | K+、Cu2+、OH-、SO42- |
14.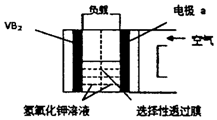 硼化钒(VB2)-空气电池是目前储电能力最高的电池(如图所示),电池总反应为:4VB2+11O2═4B2O3+2V2O5,下列叙述错误的是( )
硼化钒(VB2)-空气电池是目前储电能力最高的电池(如图所示),电池总反应为:4VB2+11O2═4B2O3+2V2O5,下列叙述错误的是( )
 硼化钒(VB2)-空气电池是目前储电能力最高的电池(如图所示),电池总反应为:4VB2+11O2═4B2O3+2V2O5,下列叙述错误的是( )
硼化钒(VB2)-空气电池是目前储电能力最高的电池(如图所示),电池总反应为:4VB2+11O2═4B2O3+2V2O5,下列叙述错误的是( )| A. | 负极反应式为4VB2+44OH-═2V2O5+4B2O3+22H2O | |
| B. | 正极反应式为11O2+44e-+22H2O=44OH- | |
| C. | OH-由负极透过性选择性透过膜向正极迁移 | |
| D. | 电子由硼化钒电极负载流向电极a |
11.化学与生产、生活、社会密切相关.下列说法正确的是( )
| A. | 葡萄酒中添加SO2,可起到抗氧化和抗菌的作用 | |
| B. | PM2.5颗粒分散到空气中可产生丁达尔效应 | |
| C. | 苯、四氯化碳、乙醇都可作萃取剂,也都能燃烧 | |
| D. | 淀粉、油脂、纤维素和蛋白质都是高分子化合物 |
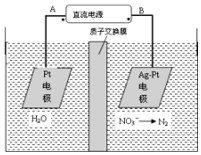 电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图,请写出阴极的电极反应式2NO3-+12H++10e-=N2↑+6H2O.
电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图,请写出阴极的电极反应式2NO3-+12H++10e-=N2↑+6H2O.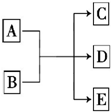 一定条件下,物质A~E转化关系如图所示,其中A为单质,常温下E为无色液体.
一定条件下,物质A~E转化关系如图所示,其中A为单质,常温下E为无色液体.