题目内容
一定条件下,体积为10L的密闭容器中,2mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z.下列说法正确的是( )
| A、以X浓度变化表示的反应速率为0.001mol/(L?S) | ||
B、将容器体积变为20L,Z的平衡浓度变为原来的
| ||
| C、若压强增大1倍,则物质Y的转化率增大1倍 | ||
| D、若升高温度,X的浓度增大,则该反应的△H>0 |
考点:化学平衡的计算
专题:化学平衡专题
分析:一定条件下,在容积为10L的密闭容器中,将1molX和1molY进行如下反应:2X(g)+Y(g)?Z(g),经60s达到平衡生成0.3mol的Z,依据平衡三段式列式得到
2X(g)+Y(g)?Z(g)
起始量(mol) 2 1 0
变化量(mol) 0.6 0.3 0.3
平衡量(mol) 1.4 0.7 0.3
依据计算结果分析选项.
2X(g)+Y(g)?Z(g)
起始量(mol) 2 1 0
变化量(mol) 0.6 0.3 0.3
平衡量(mol) 1.4 0.7 0.3
依据计算结果分析选项.
解答:
解:一定条件下,在容积为10L的密闭容器中,将1molX和1molY进行如下反应:2X(g)+Y(g)?Z(g),经60s达到平衡生成0.3mol的Z,则
2X(g)+Y(g)?Z(g)
起始量(mol) 2 1 0
变化量(mol) 0.6 0.3 0.3
平衡量(mol) 1.4 0.7 0.3
A、以X浓度变化表示的反应速率为=
=0.001mol/(L?S),故A正确;
B、将容器体积变为20L,压强减小,平衡会逆向进行,Z的平衡浓度会比原来的一半还小,故B错误;
C、若压强增大1倍,平衡正向移动,则物质Y的转化率增大1倍还要多,故C错误;
D、若升高温度,X的浓度增大,则平衡逆向移动,所以反应是放热的,则该反应的△H<0,故D错误.
故选A.
2X(g)+Y(g)?Z(g)
起始量(mol) 2 1 0
变化量(mol) 0.6 0.3 0.3
平衡量(mol) 1.4 0.7 0.3
A、以X浓度变化表示的反应速率为=
| ||
| 60s |
B、将容器体积变为20L,压强减小,平衡会逆向进行,Z的平衡浓度会比原来的一半还小,故B错误;
C、若压强增大1倍,平衡正向移动,则物质Y的转化率增大1倍还要多,故C错误;
D、若升高温度,X的浓度增大,则平衡逆向移动,所以反应是放热的,则该反应的△H<0,故D错误.
故选A.
点评:本题考查了化学平衡的三段式计算应用,平衡影响因素的分析判断,平衡移动原理的理解是解题关键,题目难度中等.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案
相关题目
2014南京青奥会,体操运动员在比赛时为了防滑.常在手掌上涂抹碳酸镁粉末,碳酸镁属于 ( )
| A、酸 | B、碱 | C、盐 | D、氧化物 |
向恒温、恒容(2L)的密闭容器中充入2mol SO2和一定量的O2,发生反应:2SO2(g)+O2(g)
2SO3(g)△H=-197.74kJ?mol-1,4min后达到平衡,这时c(SO2)=0.2mol?L-1,且SO2和O2的转化率相等.下列说法中,不正确的是( )
| 一定条件 |
| A、2 min时,c(SO2)=0.6 mol?L-1 |
| B、用O2表示4 min内的反应速率为0.1 mol?(L?min)-1 |
| C、再向容器中充入1 mol SO3,达到新平衡,n(SO2):n(O2)=2:1 |
| D、4 min后,若升高温度,平衡向逆方向移动,平衡常数K减小 |
下列实验操作能达到预期目的是( )
| A、向某无色溶液中加入BaCl2溶液产生不溶于稀HNO3的白色沉淀,说明原溶液中一定有SO42- |
| B、向某无色溶液中加入盐酸,有无色无味的气体产生,则说明原溶液中一定有CO32- |
| C、向某溶液中滴加KSCN溶液,溶液不变红,再滴加氯水,变红,说明原溶液一定有Fe2+ |
| D、将某溶液进行焰色反应时,火焰呈黄色,则溶液中一定无K+ |
在一定温度下,可逆反应达到平衡时,生成物平衡浓度的系数次方的乘积与反应物平衡浓度的系数次方的乘积之比是一个常数,该常数就叫做化学平衡常数,用符号K表示.在一定温度下的密闭容器中存在如下反应:2SO2(g)+O2(g)
2SO3(g),已知c(SO2)始=0.4mol?L-1,c(O2)始=1mol?L-1经测定该反应在该温度下的平衡常数K=19,则此反应中SO2的转化量为( )
| 催化剂 |
| △ |
| A、0.24 mol?L-1 |
| B、0.28 mol?L-1 |
| C、0.32 mol?L-1 |
| D、0.26 mol?L-1 |
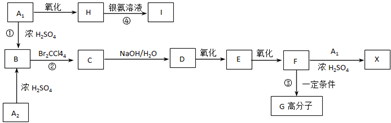
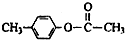 、
、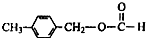 外,其余的结构简式:
外,其余的结构简式: “洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ?m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ?m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.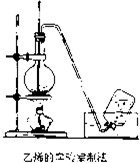 实验室制取乙烯的装置如图所示,请根据图示回答下列问题:
实验室制取乙烯的装置如图所示,请根据图示回答下列问题: