题目内容
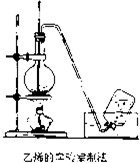 实验室制取乙烯的装置如图所示,请根据图示回答下列问题:
实验室制取乙烯的装置如图所示,请根据图示回答下列问题:(1)在烧瓶中放入酒精和浓硫酸(体积比约为1:3)的混合液,为避免混合液暴沸,常放入少量
(2)实验室制乙烯的化学方程式是:
考点:乙醇的消去反应
专题:实验题
分析:(1)乙醇沸点较低,容易发生暴沸现象,需要加入碎瓷片防止暴沸;该反应在140℃时容易发生副反应生成乙醚,所以应该加热混合液使液体温度迅速升到170℃;
(2)乙醇在浓硫酸作用下加热到170℃发生消去反应生成乙烯和水,浓硫酸起到了催化剂和脱水剂的作用.
(2)乙醇在浓硫酸作用下加热到170℃发生消去反应生成乙烯和水,浓硫酸起到了催化剂和脱水剂的作用.
解答:
解:(1)在烧瓶中放入酒精和浓硫酸(体积比约为1:3)的混合液,乙醇沸点较低,容易发生暴沸,所以为避免混合液暴沸,常放入少量碎瓷片;加热混合液时,由于140℃时容易发生副反应生成乙醚,所以应该使液体温度迅速升到170℃,
故答案为:碎瓷片;170℃;
(2)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应方程式为:CH3CH2OH
CH2=CH2↑+H2O,浓硫酸具有吸水性,所以该反应中浓硫酸具有催化性和脱水性,
故答案为:CH3CH2OH
CH2=CH2↑+H2O;催化剂、脱水剂.
故答案为:碎瓷片;170℃;
(2)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应方程式为:CH3CH2OH
| 浓硫酸 |
| 170℃ |
故答案为:CH3CH2OH
| 浓硫酸 |
| 170℃ |
点评:本题考查了乙烯的实验室制法,题目难度不大,注意掌握利用乙醇的消去反应制取乙烯的方法,明确乙烯的化学性质及检验方法,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
一定条件下,体积为10L的密闭容器中,2mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z.下列说法正确的是( )
| A、以X浓度变化表示的反应速率为0.001mol/(L?S) | ||
B、将容器体积变为20L,Z的平衡浓度变为原来的
| ||
| C、若压强增大1倍,则物质Y的转化率增大1倍 | ||
| D、若升高温度,X的浓度增大,则该反应的△H>0 |
将2.4g镁、铝混合物粉末溶于75mL 4mol/L的盐酸中,反应一段时间后,再加入250mL1.5mol/L的NaOH溶液,待反应完全,此时溶液中除Na+、Cl-外,还大量存在的是( )
| A、AlO2- |
| B、Al3+,Mg2+ |
| C、Mg2+,AlO2- |
| D、Al3+,Mg2+、H+ |
化工生产中含Cu2+的废水常用MnS(s) 作沉淀剂,其反应原理为Cu2+(aq)+MnS(s)?CuS(s)+Mn2+(aq).一定温度下,下列有关该反应的推理正确的是( )
| A、该反应达到平衡时,c(Cu2+)=c(Mn2+) |
| B、平衡体系中加入少量CuS(s) 后,c( Mn2+) 变小 |
| C、平衡体系中加入少量Cu(NO3) 2(s) 后,c( Mn2+) 变大 |
| D、该反应平衡常数表达式:K=Ksp(CuS)/Ksp(MnS) |
有关铝及其化合物的说法错误的是( )
| A、用于熔化烧碱的坩埚,可用Al2O3这种材料制成 |
| B、铝能在空气中稳定存在是因为其表面覆盖着一层氧化铝薄膜 |
| C、氧化铝是一种难熔物质,是一种较好的耐火材料 |
| D、氧化铝能中和胃酸,可用于制胃药 |