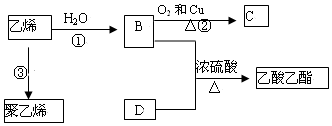
题目内容
9.0.3摩硫化亚铜与硝酸反应,若生成Cu(NO3)2、NO、S、H2O,那么在参加反应的硝酸中,未被还原的是1.2摩尔.分析 根据题意知,Cu2S与足量的稀硝酸反应生成Cu(NO3)2、S、NO和H2O,未被还原的硝酸就是硝酸铜中的硝酸根离子,根据物料守恒分析解答.
解答 解:根据题意知,Cu2S与足量的稀硝酸反应生成Cu(NO3)2、S、NO和H2O,未被还原的硝酸就是硝酸铜中的硝酸根离子,0.3摩硫化亚铜,所以硝酸铜为0.6mol,则未被还原的是1.2mol,故答案为:1.2mol.
点评 本题考查氧化还原反应的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,从化合价的角度分析氧化还原反应的相关概念和物质具有的性质,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.下列实验方法或操作正确的是( )
| A. | 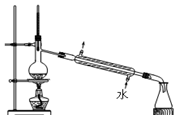 制蒸馏水 | B. | 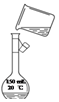 转移溶液 | ||
| C. | 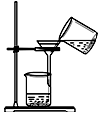 过滤 | D. | 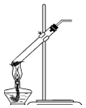 分解NaHCO3固体 |
18.将铁和三氧化二铁的混合物2.72克加入50毫升1.6摩/升的盐酸中,恰好完全反应,滴入KSCN溶液后不显红色.若忽略化学反应中溶液体积的变化,则在所得的溶液中,Fe2+离子的物质的量浓度为( )
| A. | 0.2摩/升 | B. | 0.4摩/升 | C. | 0.8摩/升 | D. | 1.6摩/升 |
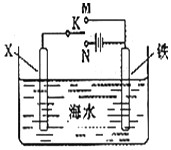 利用如图装置,可以模拟铁的电化学防护. 若X为碳棒,为减缓铁的腐蚀,开关K应该置于N(填M或者N)处,此时溶液中的阴离子向X极(填X或铁)移动.若X为锌,开光K置于M处,该电化学防护法称为:牺牲阳极的阴极保护法.
利用如图装置,可以模拟铁的电化学防护. 若X为碳棒,为减缓铁的腐蚀,开关K应该置于N(填M或者N)处,此时溶液中的阴离子向X极(填X或铁)移动.若X为锌,开光K置于M处,该电化学防护法称为:牺牲阳极的阴极保护法.
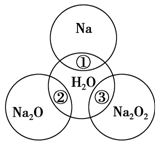 如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g,忽略溶液中溶剂的变化.完成下列题目.
如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g,忽略溶液中溶剂的变化.完成下列题目.