题目内容
19.氨气极易溶于水,其水溶液显碱性(酸性、中性、碱性).氨气和氯化氢在空气中相遇时,可以看到的现象是白烟.分析 氨气和水反应生成氨水,氨水电离生成氢氧根离子和铵根离子,有关的方程式为:NH3+H2O?NH3.H2O?NH4++OH-;氯化氢和氨气混合产生大量白烟过程中有新物质氯化铵生成,氯化铵固体小颗粒,由此分析解答.
解答 解:氨气和水反应生成氨水,氨水电离生成氢氧根离子和铵根离子,有关的方程式为:NH3+H2O?NH3.H2O?NH4++OH-,溶液呈碱性; 氯化氢和氨气混合产生大量白烟过程中有新物质氯化铵生成,氯化铵固体小颗粒,产生大量的白烟,故答案为:碱性;白烟.
点评 本题主要考查了微观粒子的特征及其根据反应现象判断粒子性质方面的内容.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.NaNO2是一种食品添加剂,它与酸性KMnO4溶液可发生反应MnO4-+NO2-+H+→Mn2++NO3-+H2O(未配平).下列叙述中正确的是( )
| A. | 生成1 mol NaNO3需消耗0.4 mol KMnO4 | |
| B. | 反应过程中溶液的酸性增强 | |
| C. | 该反应中NO2-被还原 | |
| D. | H+可以是盐酸 |
10.常温下,下列有关电解质溶液的说法正确的是( )
| A. | pH=3的强酸溶液1ml,加水稀释至100ml后,溶液pH降低2个单位 | |
| B. | 0.2molCO2通入1L0.3mol•L-1 KOH溶液中:2 c(H+)+c(HCO3-)+3c(H2CO3)=2 c(OH-)+2c(CO32-) | |
| C. | 已知一定浓度的NaHSO3溶液pH=5.4,则c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) | |
| D. | pH相同的①CH3COONa ②NaHCO3③NaClO三种溶液中的c(Na+):①<②<③ |
7.下列溶液一定呈中性的是( )
| A. | c(H+)•c(OH-)=10-14的溶液 | B. | pH=7的溶液 | ||
| C. | c(H+)=c(OH-)的溶液 | D. | 使石蕊溶液呈紫色的溶液 |
11.下列说法错误的是( )
| A. | 6.02×1023是阿伏加德罗常数的近似值 | |
| B. | 1 mol 12C的质量是12 g | |
| C. | 含有阿伏加德罗常数个粒子的物质就是1 mol | |
| D. | 1 mol O2含有6.02×1023个氧原子 |
8.下列叙述中错误的是( )
| A. | 常温常压下,0.5NA个氯气分子所占体积约是11.2 L | |
| B. | 从1L1mol/L的氯化钠溶液中取出10ml,其浓度仍是1mol/L | |
| C. | 制成0.5L10mol/L的盐酸,需要氯化氢气体112L(标准状况) | |
| D. | NA个氧气分子和NA个氢气分子的质量比等于16:1 |
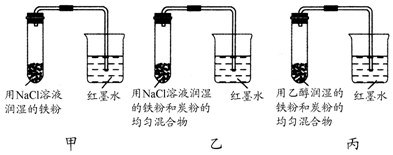
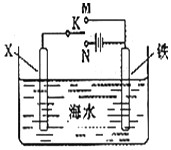 利用如图装置,可以模拟铁的电化学防护. 若X为碳棒,为减缓铁的腐蚀,开关K应该置于N(填M或者N)处,此时溶液中的阴离子向X极(填X或铁)移动.若X为锌,开光K置于M处,该电化学防护法称为:牺牲阳极的阴极保护法.
利用如图装置,可以模拟铁的电化学防护. 若X为碳棒,为减缓铁的腐蚀,开关K应该置于N(填M或者N)处,此时溶液中的阴离子向X极(填X或铁)移动.若X为锌,开光K置于M处,该电化学防护法称为:牺牲阳极的阴极保护法.