题目内容
16.能源是人类生存和发展的重要支柱,研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义,已知下列热化学方程式①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-242kJ/mol;
②2H2(g)+O2(g)=2H2O(l)△H=-572kJ/mol;
③C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/moL;
④C(s)+O2(g)=CO2(g)△H=-393.5kJ/moL;
⑤CO2(g)+2H2O(g)=CH4(g)+2O2(g)△H=+802kJ/moL
| 化学键 | O=O | C-C | H-H | O-O | C-O | O-H | C-H |
| 键能kJ/mol | 497 | 348 | 436 | 142 | 351 | 463 | 414 |
(1)写出能表示H2燃烧热的热化学方程式:H2(g)+0.5 O2(g)=H2O(l)△H=-286kJ/mol
(2)计算C(s)+H2O(g)?H2(g)+CO(g)△H=+131.5 kJ/moL;
(3)估算出C=O键能为800kJ/moL.
(4)CH4的燃烧热△H=-890 kJ/moL.
(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开1L水所需要的CH4的物质的量为0.56mol[保留到小数点后2位;已知:c (H2O)=4.2J/(g•℃)].
分析 (1)因燃烧热在某一温度和压强下lmol某物质B完全燃烧生成稳定化合物时所释放出的热量,由②可得H2的燃烧热为286kJ•mol-1;
(2)根据方程式①、③运用盖斯定律求得反应热;
(3)依据反应⑤的反应焓变,结合焓变=反应物键能总和-生成物键能总和;
(4)燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物的过程中放出的热量,结合①②⑤热化学方程式和盖斯定律计算;
(5)根据题意求出的甲烷燃烧热计算CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%时放出的热量,再根据水烧开需要的热量计算需要甲烷的物质的量.
解答 解:(1)因燃烧热在某一温度和压强下lmol某物质B完全燃烧生成稳定化合物时所释放出的热量,由②可得H2的燃烧热为286kJ•mol-1;所以热化学方程式为:H2(g)+0.5 O2(g)=H2O(l)△H=-286kJ/mol,故答案为:H2(g)+0.5 O2(g)=H2O(l)△H=-286kJ/mol;
(2)因③-①可得:C(s)+H2O(g)=H2(g)+CO (g)△H=+131.5kJ•mol-1,故答案为:+131.5;
(3)CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H═+802kJ/moL,设C=O键能为x,
反应焓变△H=反应物键能总和-生成物键能总和=2x+2×2×463KJ/mol-(4×414KJ/mol+2×497KJ/mol)=802KJ/mol
x=800KJ/mol;
故答案为:800;
(4)①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H═-242kJ/mol;
②H2(g)+$\frac{1}{2}$ O2(g)=H2O(l)△H=-286kJ/mol;
⑤CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H═+802kJ/moL
[①×2-②]-⑤,CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H═890KJ/mol;
故答案为:890;
(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开1L水所需要的CH4的物质的量设为x,依据甲烷的燃烧热CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H═890KJ/mol,计算得到:
90%×890KJ/mol×70%=1000g×4.2×10-3KJ/g•℃×(100-25)℃×x
x=0.56
故答案为:0.56.
点评 本题考查了热化学方程式书写方法和盖斯定律计算应用,键能和焓变的计算关系应用,水的热容计算判断,掌握基础是关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 硫酸铝溶液与过量Ba(OH)2溶液反应2Al3++3SO42-+3 Ba2++8OH-═3BaSO4↓+2A1O2-+4H2O | |
| B. | 碳酸钠溶液中滴加盐酸至恰好要出现气泡时停止:CO32-+2H+═CO2↑+H2O | |
| C. | 酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H2O2+6H+═2Mn2++6H2O+02↑ | |
| D. | 氯气通入亚硫酸钠溶液中:2Cl2+SO32-+H2O═2Cl-+SO2↑+2HClO |
| A. | c(H+)•c(OH-)=10-14的溶液 | B. | pH=7的溶液 | ||
| C. | c(H+)=c(OH-)的溶液 | D. | 使石蕊溶液呈紫色的溶液 |
| A. | 6.02×1023是阿伏加德罗常数的近似值 | |
| B. | 1 mol 12C的质量是12 g | |
| C. | 含有阿伏加德罗常数个粒子的物质就是1 mol | |
| D. | 1 mol O2含有6.02×1023个氧原子 |
| A. | 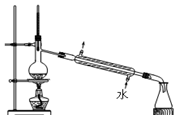 制蒸馏水 | B. | 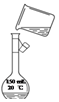 转移溶液 | ||
| C. | 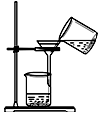 过滤 | D. | 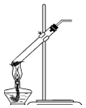 分解NaHCO3固体 |
| A. | 常温常压下,0.5NA个氯气分子所占体积约是11.2 L | |
| B. | 从1L1mol/L的氯化钠溶液中取出10ml,其浓度仍是1mol/L | |
| C. | 制成0.5L10mol/L的盐酸,需要氯化氢气体112L(标准状况) | |
| D. | NA个氧气分子和NA个氢气分子的质量比等于16:1 |
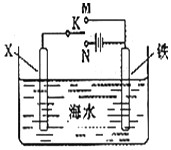 利用如图装置,可以模拟铁的电化学防护. 若X为碳棒,为减缓铁的腐蚀,开关K应该置于N(填M或者N)处,此时溶液中的阴离子向X极(填X或铁)移动.若X为锌,开光K置于M处,该电化学防护法称为:牺牲阳极的阴极保护法.
利用如图装置,可以模拟铁的电化学防护. 若X为碳棒,为减缓铁的腐蚀,开关K应该置于N(填M或者N)处,此时溶液中的阴离子向X极(填X或铁)移动.若X为锌,开光K置于M处,该电化学防护法称为:牺牲阳极的阴极保护法.