题目内容
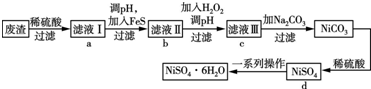
8.硅孔雀石是一种含铜矿石,含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质.以其为原料制取硫酸铜的工艺流程如图: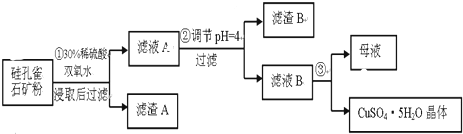
(1)完成步骤①中稀硫酸与CuSiO3•2H2O反应的化学方程式:CuSiO3•2H2O+H2SO4=CuSO4+H4SiO4+H2O;双氧水的作用是将Fe2+氧化成Fe3+.
(2)步骤②调节溶液pH,可以选用的试剂是AD
A.CuOB.Fe2O3 C.Al2O3D Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(4)将滤液B通过蒸发浓缩、冷却结晶,过滤等操作可得到硫酸铜晶体.
(5)测定硫酸铜晶体结晶水的含量时,应将其放入坩埚中灼烧.加热失水后,若在空气中冷却称量,测定结果偏低(填“偏高”、“偏低”或“不变”).
分析 (1)根据质量守恒定律,未知物应该是硅酸,利用观察法配平反应方程式即可;双氧水将亚铁离子氧化成铁离子的离子方程式;
(2)根据滤液A显示酸性,加入的试剂不能引进新的杂质进行分析;
(3)根据氢氧化物开始沉淀和完全沉淀的pH列表进行分析PH=4完全沉淀、不完全沉淀的离子;
(4)滤液得到溶质晶体的方法是蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铜晶体;
(5)根据测定硫酸铜晶体中结晶水含量的实验步骤选择使用的仪器;空气中冷却,称量的固体质量增加,测量结果偏低.
解答 解:(1)利用质量守恒定律,可以判断未知物是硅酸,利用观察法配平反应方程式为:CuSiO3•2H2O+H2SO4═CuSO4+H4SiO4+H2O;双氧水将亚铁离子氧化成铁离子的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O;
故答案为:H4SiO4;将Fe2+氧化成Fe3+;
(2)由于滤液A显示酸性,加入的试剂能够中和溶液中的氢离子,还不能引进新的杂质,所以应该选用氧化铜,氢氧化铜,故选AD;
故答案为:AD;
(3)步骤②中,调节pH=4时,所得滤渣B的成分依据表中数据可知,pH=4时,三价铁离子完全生成了氢氧化铁沉淀,而铝离子完全沉淀需要的PH是5.2,所以铝离子没有完全沉淀,铝离子有少量沉淀,所以渣B的成分为:Fe(OH)3、Al(OH)3 ,
故答案为:Fe(OH)3;Al(OH)3 ;
(4)滤液B为硫酸铜溶液,通过蒸发浓缩、冷却结晶,过滤洗涤等操作可得到硫酸铜晶体;
故答案为:蒸发浓缩;冷却结晶;
(5)测定硫酸铜晶体中结晶水的含量,需要的仪器是酒精灯、托盘天平、三角架、泥三角、玻璃棒、干燥器、坩埚钳、研钵、药匙和坩埚;若是在空中冷却后称量,导致称量的剩余固体质量偏大,计算出结晶水的质量偏小,结果偏低;
故答案为:坩埚;偏低.
点评 本题借助硅孔雀石为原料制取硫酸铜的工艺流程,考查了化学方程式书写、误差分析、化学计算等知识,可以根据所学知识完成,本题难度中等.

| A. | 标准状况下,5.6L 四氯化碳含有的分子数为0.25NA | |
| B. | 标准状况下,14g 氮气含有的核外电子数为5NA | |
| C. | 标准状况下,22.4L任意比的氢气和氯气的混合气体中含有的分子总数均为NA | |
| D. | 常温常压下,22.4L CO2中含有NA个CO2分子 |
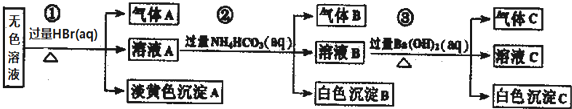
| A. | 根据实验①中的现象可推出,气体A一定是纯净物,淡黄色沉淀一定是AgBr | |
| B. | 根据实验②中的现象可推出,气体B是CO2,沉淀B是Al(OH)3,原溶液中一定含有Al3+ | |
| C. | 根据实验③中的现象可推出,气体C是NH3,沉淀C一定有BaCO3,可能有BaSO4 | |
| D. | 原溶液中肯定含有Na+、AlO2-、S2-,不能确定是否含有SO32-、SO42- |
| A. | CO2+2OH-=CO32-+H2O | B. | Al2O3+2OH-=2 AlO2-+H2O | ||
| C. | 2 Al+2OH-+2H2O=2 AlO2-+3H2↑ | D. | Al3++4 OH-=AlO2-+2H2O |
| A. | X2YZ3 | B. | XYZ2 | C. | X3YZ4 | D. | XYZ3 |
| A. | 已知冰的熔化热为6.0kJ•mol-1,冰中氢键键能为20kJ•mol-1,假设每摩尔冰中有2mol氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,Ka=(ca)2/c(1-a).若加水稀释,则CH3COOH?CH3COO-+H+向右移动,a增大,Ka不变 | |
| C. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1 | |
| D. | 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃.30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 |
| A. | Mg原子结构示意图: | B. | 乙烯结构简式:CH2═CH2 | ||
| C. | NaCl的电子式: | D. | 甲烷的结构式: |
| A. | 含有0.1molNH3•H2O分子 | |
| B. | 溶液中NH3的物质的量浓度为0.2 mol•L-1 | |
| C. | NH3和NH3•H2O的物质的量之和为0.2 mol•L-1 | |
| D. | NH3、NH3•H2O和NH4+的物质的量总和为0.1 mol |