题目内容
3.X、Y、Z为短周期元素,它们依次位于ⅠA族、VA族、ⅥA族,则由这三种元素组成的化合物的化学式不可能是( )| A. | X2YZ3 | B. | XYZ2 | C. | X3YZ4 | D. | XYZ3 |
分析 X、Y、Z分别是在ⅠA族、ⅣA族和ⅥA族,因此X、Y显正价,而Z只能显负价(-2),X只能显+1价,因此求出Y显的价数与其所在的位置ⅥA族相符即可,以此解答该题.
解答 解:A.X2YZ3中Y的化合价为+4价,不是ⅥA族元素,故A错误;
B.Y为+3价,为亚硝酸,故B正确;
C.Y为+5价,可为磷酸等,故C正确;
D.Y为+5价,可为硝酸,故D正确.
故选A.
点评 本题考查元素推断题,为高频考点,考查角度为根据原子核外电子排布特点推断元素种类,并判断可能的化合物,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.如图所示是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )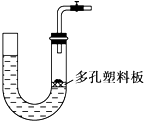

| A. | 大理石和稀硫酸制取二氧化碳 | B. | 锌粒和稀硫酸制氢气 | ||
| C. | 块状碳酸钠和稀盐酸制取二氧化碳 | D. | 氯酸钾和二氧化锰制取氧气 |
18.X、Y、Z、M、R、Q 是短周期主族元素,部分信息如表所示:
(1)X 和 M 的原子可构成 18 电子的分子,该分子的结构式为H-O-O-H.
(2)R 元素的单质与水反应的离子方程式是Cl2+H2O═H++Cl-+HClO.
(3)Z 与 Q 相比,金属性较强的是Na(用元素符号表示),下列事实能证明这一 结论的是bc(填字母序号).
a.Q 的熔点比 Z 的熔点高,Q 的硬度比 Z 的硬度大
b.Z 与冷水反应迅速,而 Q 与冷水几乎不反应
c.Z 的最高价氧化物对应水化物是强碱,而 Q 的最高价氧化物对应水化物具有两性
(4)与 Y 元素同主族的短周期元素 E 在自然界中存在多种核素,它们之间的关系互为同位素,其中用于测定一些文物年代的核素的符号为146C(或14C).
(5)写 出 Z2M2与 X2M 反 应 的 化 学 方 程 式 并 标 出 电 子 转 移 关 系 .
.
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | |||||
| 其他 | 阳离子 核外无电子 | 无机非金属材料的主角 | 焰色反 应呈黄色 |
(2)R 元素的单质与水反应的离子方程式是Cl2+H2O═H++Cl-+HClO.
(3)Z 与 Q 相比,金属性较强的是Na(用元素符号表示),下列事实能证明这一 结论的是bc(填字母序号).
a.Q 的熔点比 Z 的熔点高,Q 的硬度比 Z 的硬度大
b.Z 与冷水反应迅速,而 Q 与冷水几乎不反应
c.Z 的最高价氧化物对应水化物是强碱,而 Q 的最高价氧化物对应水化物具有两性
(4)与 Y 元素同主族的短周期元素 E 在自然界中存在多种核素,它们之间的关系互为同位素,其中用于测定一些文物年代的核素的符号为146C(或14C).
(5)写 出 Z2M2与 X2M 反 应 的 化 学 方 程 式 并 标 出 电 子 转 移 关 系
 .
.
8.硅孔雀石是一种含铜矿石,含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质.以其为原料制取硫酸铜的工艺流程如图:
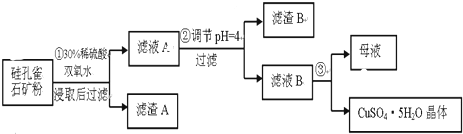
(1)完成步骤①中稀硫酸与CuSiO3•2H2O反应的化学方程式:CuSiO3•2H2O+H2SO4=CuSO4+H4SiO4+H2O;双氧水的作用是将Fe2+氧化成Fe3+.
(2)步骤②调节溶液pH,可以选用的试剂是AD
A.CuOB.Fe2O3 C.Al2O3D Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
步骤②中,调节pH=4时,所得滤渣B的成分的化学式为Fe(OH)3、Al(OH)3.
(4)将滤液B通过蒸发浓缩、冷却结晶,过滤等操作可得到硫酸铜晶体.
(5)测定硫酸铜晶体结晶水的含量时,应将其放入坩埚中灼烧.加热失水后,若在空气中冷却称量,测定结果偏低(填“偏高”、“偏低”或“不变”).

(1)完成步骤①中稀硫酸与CuSiO3•2H2O反应的化学方程式:CuSiO3•2H2O+H2SO4=CuSO4+H4SiO4+H2O;双氧水的作用是将Fe2+氧化成Fe3+.
(2)步骤②调节溶液pH,可以选用的试剂是AD
A.CuOB.Fe2O3 C.Al2O3D Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(4)将滤液B通过蒸发浓缩、冷却结晶,过滤等操作可得到硫酸铜晶体.
(5)测定硫酸铜晶体结晶水的含量时,应将其放入坩埚中灼烧.加热失水后,若在空气中冷却称量,测定结果偏低(填“偏高”、“偏低”或“不变”).
15.由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Cu2+、Ba2+、C1-、SO42-、CO32-.将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验:
试回答下列问题:
(1)该混合物中一定不存在的离子是Mg2+、Cu2+、Ba2+ .
(2)试写出实验b发生反应的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(3)溶液中一定存在的阴离子及其物质的量浓度(可不填满):
(4)判断混合物中是否存在K+,如果不存在,请说明理由,如果存在,请求出C(K+)的取值范围?c(K+)≥0.1mol/L
(5)Ba2+是一种重金属离子,某环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度.取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加0.100mol•L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL.已知有关的离子方程式为:
①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;
②I2+2S2O32-=2I-+S4O62-.
试计算该工厂废水中Ba2+的物质的量浓度0.024mol•L-1.(写出具体计算过程)
| 实验序号 | 实验内容 | 实验结果 |
| a | 加AgNO3溶液 | 有白色沉淀生成 |
| b | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准 状况下的体积) |
| c | 加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次 称量读数为2.33g |
(1)该混合物中一定不存在的离子是Mg2+、Cu2+、Ba2+ .
(2)试写出实验b发生反应的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(3)溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 | 物质的量浓度(mol•L-1) |
(5)Ba2+是一种重金属离子,某环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度.取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加0.100mol•L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL.已知有关的离子方程式为:
①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;
②I2+2S2O32-=2I-+S4O62-.
试计算该工厂废水中Ba2+的物质的量浓度0.024mol•L-1.(写出具体计算过程)
12.下面的原子或原子团不属于官能团的是( )
| A. | NO3- | B. | -NO2 | C. | -OH | D. | -COOH |
13.在一定条件下,将乙醇蒸气和乙烯的混合气体VL点燃,使其完全燃烧后,消耗相同条件下氧气的体积是( )
| A. | 2VL | B. | 2.5VL | C. | 3VL | D. | 无法计算 |
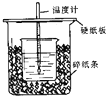 50mL0.50mol/L 盐酸与50mL0.55mol/LNaOH 溶液在如图所示的装置中进行中和反应.
50mL0.50mol/L 盐酸与50mL0.55mol/LNaOH 溶液在如图所示的装置中进行中和反应.