题目内容
17.下列化学用语不正确的是( )| A. | Mg原子结构示意图: | B. | 乙烯结构简式:CH2═CH2 | ||
| C. | NaCl的电子式: | D. | 甲烷的结构式: |
分析 A、镁原子的核外有12个电子;
B、乙烯的两个碳原子间为碳碳双键;
C、氯化钠为离子化合物;
D、用短线“-”代替共用电子对即得甲烷结构式.
解答 解:A、镁原子的核外有12个电子,故原子结构示意图为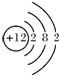 ,故A错误;
,故A错误;
B、乙烯的两个碳原子间为碳碳双键,故结构简式为CH2═CH2,故B正确;
C、氯化钠为离子化合物,由钠离子和氯离子构成,故电子式为 ,故C正确;
,故C正确;
D、甲烷的电子式为 ,用短线“-”代替共用电子对即得甲烷结构式,故甲烷的结构式为
,用短线“-”代替共用电子对即得甲烷结构式,故甲烷的结构式为 ,故D正确;
,故D正确;
故选A.
点评 本题考查了常见的化学用语的应用,难度不大,应注意共价化合物和离子化合物电子式的书写方法的区别.

练习册系列答案
相关题目
7.下列有关物质用途的叙述错误的是( )
| A. | 硫磺有杀虫、杀螨、杀菌作用 | |
| B. | 石膏可以用做雕像材料 | |
| C. | 碳酸钡常用于治疗胃病,俗称“钡餐” | |
| D. | 明矾可做净水剂 |
8.硅孔雀石是一种含铜矿石,含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质.以其为原料制取硫酸铜的工艺流程如图:
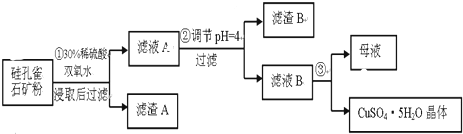
(1)完成步骤①中稀硫酸与CuSiO3•2H2O反应的化学方程式:CuSiO3•2H2O+H2SO4=CuSO4+H4SiO4+H2O;双氧水的作用是将Fe2+氧化成Fe3+.
(2)步骤②调节溶液pH,可以选用的试剂是AD
A.CuOB.Fe2O3 C.Al2O3D Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
步骤②中,调节pH=4时,所得滤渣B的成分的化学式为Fe(OH)3、Al(OH)3.
(4)将滤液B通过蒸发浓缩、冷却结晶,过滤等操作可得到硫酸铜晶体.
(5)测定硫酸铜晶体结晶水的含量时,应将其放入坩埚中灼烧.加热失水后,若在空气中冷却称量,测定结果偏低(填“偏高”、“偏低”或“不变”).

(1)完成步骤①中稀硫酸与CuSiO3•2H2O反应的化学方程式:CuSiO3•2H2O+H2SO4=CuSO4+H4SiO4+H2O;双氧水的作用是将Fe2+氧化成Fe3+.
(2)步骤②调节溶液pH,可以选用的试剂是AD
A.CuOB.Fe2O3 C.Al2O3D Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(4)将滤液B通过蒸发浓缩、冷却结晶,过滤等操作可得到硫酸铜晶体.
(5)测定硫酸铜晶体结晶水的含量时,应将其放入坩埚中灼烧.加热失水后,若在空气中冷却称量,测定结果偏低(填“偏高”、“偏低”或“不变”).
5.下列有关叙述正确的是( )
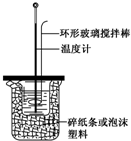

| A. | 如图所示,测定中和热时,大小两烧杯间填满碎纸条或泡沫塑料的目的是固定小烧杯 | |
| B. | 若用50 mL 0.55 mol•L-1的氢氧化钠溶液,分别与50 mL 0.50 mol•L-1的盐酸和50 mL 0.50 mol•L-1的硫酸充分反应,两反应测定的中和热不相等 | |
| C. | 中和热测定实验也可以用稀硫酸与氢氧化钠溶液反应 | |
| D. | 为了简化装置,中和热测定实验中的环形玻璃搅拌棒可以由温度计代替 |
12.下面的原子或原子团不属于官能团的是( )
| A. | NO3- | B. | -NO2 | C. | -OH | D. | -COOH |
2.有下列物质:①石墨 ②铜丝 ③氧气 ④二氧化碳 ⑤NaCl固体 ⑥稀H2SO4 ⑦水 ⑧硫酸钡 ⑨金刚石,以下组合正确的是( )
| A. | 能导电的有①②⑤⑥ | |
| B. | 属于电解质的有⑤⑦⑧ | |
| C. | 属于强电解质的有⑤⑥⑧ | |
| D. | 既不属于电解质又不属于非电解质的有①②③④ |
9.下列实验操作与实验目的相对应的是( )
| 实验操作 | 实验目的 | |
| A | 打开分液漏斗开关,使蒸馏水滴到烧瓶中的电石上 | 制备乙炔气体 |
| B | 乙醇中有少量水,加入生石灰充分搅拌后蒸馏 | 除去乙醇中的水 |
| C | 加入过量饱和溴水 | 检验苯中是否含有苯酚 |
| D | 将溴乙烷与氢氧化钠水溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 | 检验溴乙烷中的溴原子 |
| A. | A | B. | B | C. | C | D. | D |
6.向35.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体完全反应,生成NO 和Cu(NO3)2.在所得溶液中加入1.0mol/L 的NaOH溶液1.3L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为49g.下列有关说法正确的是( )
| A. | Cu与Cu2O 的物质的量之比为2:1 | |
| B. | 硝酸的物质的量浓度为2.6mol/L | |
| C. | 产生的NO在标准状况下的体积为4.48L | |
| D. | Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |