题目内容
20.下列说法不正确的是( )| A. | 已知冰的熔化热为6.0kJ•mol-1,冰中氢键键能为20kJ•mol-1,假设每摩尔冰中有2mol氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,Ka=(ca)2/c(1-a).若加水稀释,则CH3COOH?CH3COO-+H+向右移动,a增大,Ka不变 | |
| C. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1 | |
| D. | 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃.30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 |
分析 A.熔化热是指:单位质量的晶体物质在熔点时变成同温度的液态物质所需吸收的热量,单位是焦/千克;
氢键是一种比分子间作用力稍强,比共价键和离子键弱很多的相互作用.其稳定性弱于共价键和离子键;
B.电离度与弱电解质的电离程度有关.不同的弱电解质电离的程度不同,电离度是指:弱电解质在溶液里达电离平衡时,已电离的电解质分子数占原来总分子数(包括已电离的和未电离的)的百分数,加入水稀释促进电离,电离程度增大,电离平衡常数随温度变化;
C.甲烷的燃烧热指1molCH4完全燃烧生成稳定氧化物时放出的热量;
D.0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,相同条件下的同一可逆反应,正逆反应反应热数值相等,符号相反.
解答 解:A.冰是由水分子通过氢键形成的分子晶体,冰的熔化热为6.0kJ•mol-1,1mol冰变成0℃的液态水所需吸收的热量为6.0kJ,全用于打破冰的氢键,冰中氢键键能为20.0kJ•mol-1,1mol冰中含有2mol氢键,需吸收40.0kJ的热量.6.0kJ/40.0kJ×100%=15%.由计算可知,最多只能打破1mol冰中全部氢键的15%,故A正确;
B.Ka是电离常数,是弱电解质达电离平衡时的平衡常数,在一定温度下,与浓度无关.Ka的计算用溶液中电离出来的各离子浓度乘积与溶液中未电离的电解质分子浓度的比值,一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,CH3COOH?CH3COO-+H+醋酸电离出的CH3COO-和H+浓度均为cα,溶液中未电离的电解质分子浓度为c(1-α),故题中Ka=$\frac{(cα)^{2}}{c(1-α)}$.若加水稀释,促进电离,CH3COOH?CH3COO-+H+向右移动,α增大,温度不变,Ka不变,故B正确;
C.根据燃烧热的概念:1mol可燃物完全燃烧生成稳定的氧化物,甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1,故C正确;
D.相同条件下的同一可逆反应,正逆反应反应热数值相等,符号相反,0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,所以生成2mol氨气,放出的热量小于38.6kJ,△H>-38.6kJ•mol-1,故D错误;
故选D.
点评 本题是关于计算的综合题,熟悉键能与熔化热、燃烧热判断键型的应用、电离度与电离平衡常数、反应热的盖斯定律计算、可逆反应等知识即可解答,注意做好各种相关计算教学是定量理解原理的意义所在,各知识点的计算都要达到理解、应用式计算而不是流于形式的简单算计,侧重考查各种反应量的计算能力.

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案| A. | Fe3+、Al3+ | B. | Al3+ | C. | Fe2+、NH4+ | D. | Fe3+ |
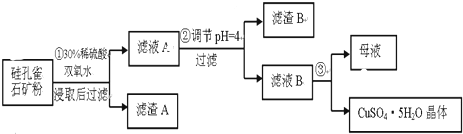
(1)完成步骤①中稀硫酸与CuSiO3•2H2O反应的化学方程式:CuSiO3•2H2O+H2SO4=CuSO4+H4SiO4+H2O;双氧水的作用是将Fe2+氧化成Fe3+.
(2)步骤②调节溶液pH,可以选用的试剂是AD
A.CuOB.Fe2O3 C.Al2O3D Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(4)将滤液B通过蒸发浓缩、冷却结晶,过滤等操作可得到硫酸铜晶体.
(5)测定硫酸铜晶体结晶水的含量时,应将其放入坩埚中灼烧.加热失水后,若在空气中冷却称量,测定结果偏低(填“偏高”、“偏低”或“不变”).
| 实验序号 | 实验内容 | 实验结果 |
| a | 加AgNO3溶液 | 有白色沉淀生成 |
| b | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准 状况下的体积) |
| c | 加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次 称量读数为2.33g |
(1)该混合物中一定不存在的离子是Mg2+、Cu2+、Ba2+ .
(2)试写出实验b发生反应的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(3)溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 | 物质的量浓度(mol•L-1) |
(5)Ba2+是一种重金属离子,某环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度.取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加0.100mol•L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL.已知有关的离子方程式为:
①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;
②I2+2S2O32-=2I-+S4O62-.
试计算该工厂废水中Ba2+的物质的量浓度0.024mol•L-1.(写出具体计算过程)
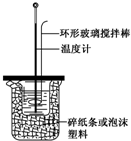
| A. | 如图所示,测定中和热时,大小两烧杯间填满碎纸条或泡沫塑料的目的是固定小烧杯 | |
| B. | 若用50 mL 0.55 mol•L-1的氢氧化钠溶液,分别与50 mL 0.50 mol•L-1的盐酸和50 mL 0.50 mol•L-1的硫酸充分反应,两反应测定的中和热不相等 | |
| C. | 中和热测定实验也可以用稀硫酸与氢氧化钠溶液反应 | |
| D. | 为了简化装置,中和热测定实验中的环形玻璃搅拌棒可以由温度计代替 |
| A. | NO3- | B. | -NO2 | C. | -OH | D. | -COOH |
| 实验操作 | 实验目的 | |
| A | 打开分液漏斗开关,使蒸馏水滴到烧瓶中的电石上 | 制备乙炔气体 |
| B | 乙醇中有少量水,加入生石灰充分搅拌后蒸馏 | 除去乙醇中的水 |
| C | 加入过量饱和溴水 | 检验苯中是否含有苯酚 |
| D | 将溴乙烷与氢氧化钠水溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 | 检验溴乙烷中的溴原子 |
| A. | A | B. | B | C. | C | D. | D |
 )混合物进行酯化反应,可得甘油三酯最多有(不考虑立体异构)( )
)混合物进行酯化反应,可得甘油三酯最多有(不考虑立体异构)( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
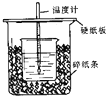 50mL0.50mol/L 盐酸与50mL0.55mol/LNaOH 溶液在如图所示的装置中进行中和反应.
50mL0.50mol/L 盐酸与50mL0.55mol/LNaOH 溶液在如图所示的装置中进行中和反应.