题目内容
6.下列物质中,既含有离子键,又含有共价键的是( )| A. | H2O2 | B. | NaOH | C. | CaO | D. | SO2 |
分析 一般来说,活泼金属元素与活泼非金属元素形成离子键,非金属元素之间形成共价键,以此来解答.
解答 解:A.H2O2中只含O-H、O-O共价键,故A不选;
B.NaOH中含离子键和共价键,故B选;
C.CaO中只含离子键,故C不选;
D.SO2中只含共价键,故D不选;
故选B.
点评 本题考查化学键,把握离子键、共价键判断的一般规律为解答的关键,注意特殊物质中的化学键(氯化铝、铵盐等),题目难度不大.

练习册系列答案
相关题目
17.将100mL2mol/LAlCl3溶液跟一定体积4mol/LNaOH溶液混合后可得7.8g沉淀,则NaOH溶液的体积可能是:①75mL②150mL③175mL④200mL( )
| A. | ① | B. | ② | C. | ①③ | D. | ②③ |
1.有主族元素A、B、C、D、E,相对位置如图所示.C的原子序数是D的两倍.
(1)E位于元素周期表中第四周期,第VA族,该周期共有18种元素
(2)上述五种元素的最高价氧化物对应的水化物酸性最强的是(写酸的化学式)H2SO4
(3)上述五种元素的氢化物稳定性最强的是(写氢化物的化学式)H2O,用电子式表示该物质的形成过程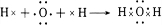 .
.
| D | ||
| A | B | C |
| E |
(2)上述五种元素的最高价氧化物对应的水化物酸性最强的是(写酸的化学式)H2SO4
(3)上述五种元素的氢化物稳定性最强的是(写氢化物的化学式)H2O,用电子式表示该物质的形成过程
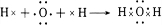 .
.
11.在3NO2+H2O=2HNO3+NO反应中,氧化剂与还原剂的分子数为( )
| A. | 1:2 | B. | 3:1 | C. | 1:1 | D. | 1:3 |
18.甲、乙两种非金属元素,能说明甲比乙的非金属性强的是( )
①甲单质比乙单质容易与氢气化合
②甲元素的单质能与乙的阴离子发生氧化还原反应
③甲的最高价氧化物对应水化物的酸性比乙的最高价氧化物对应水化物的酸性强
④与某金属反应时,甲比乙得电子数多
⑤甲的单质熔沸点比乙的单质低.
①甲单质比乙单质容易与氢气化合
②甲元素的单质能与乙的阴离子发生氧化还原反应
③甲的最高价氧化物对应水化物的酸性比乙的最高价氧化物对应水化物的酸性强
④与某金属反应时,甲比乙得电子数多
⑤甲的单质熔沸点比乙的单质低.
| A. | 只有③④ | B. | 只有①②⑤ | C. | 只有①②③ | D. | ①②③④⑤ |
15.有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
| A. | 2-乙基丁烷 | B. | 二溴乙烷 | C. | 2-甲基丁烯 | D. | 苯甲醇 |
16.下列物质的性质与氢键无关的是( )
| A. | 甲烷的熔沸点比硅烷的低 | |
| B. | NH3易液化 | |
| C. | NH3分子比PH3分子稳定 | |
| D. | 在相同条件下,H2O的沸点比H2S的沸点高 |
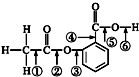 阿司匹林的结构简式如图,①②③④⑤⑥分别标出了其分子中不同的键.请判断阿司匹林与乙醇发生反应时,断键的位置是( )
阿司匹林的结构简式如图,①②③④⑤⑥分别标出了其分子中不同的键.请判断阿司匹林与乙醇发生反应时,断键的位置是( ) ,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.