题目内容
20.下列说法正确的是( )| A. | 纳米铁粉可以高效地去除被污染水体中的 Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子有较强的物理吸附 | |
| B. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| C. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| D. | 火力发电中,燃烧是使化学能转换为电能的关键 |
分析 A、Fe和Pb2+、Cu2+、Hg2+发生置换反应;
B、食品添加剂包括酸度调节剂、抗结剂、消泡剂、抗氧化剂、漂白剂、膨松剂、着色剂、护色剂、酶制剂、增味剂、营养强化剂、防腐剂、甜味剂、增稠剂、香料等;
C、煤的气化和液化均为化学变化;
D、在火力发电时,先将化学能转变为热能,然后热能转变为机械能,最后转变为电能.
解答 解:A、除了污水时Fe和Pb2+、Cu2+、Hg2+发生置换反应,发生化学反应,与物理吸附无关,故A错误;
B、我国把营养强化剂也归为食品添加剂的范畴,包括对人体有益的某些氨基酸类,盐类,矿物质类,膳食纤维等,故B错误;
C、煤的气化是用煤制取水煤气,煤的液化是用煤制取甲醇,故均为化学变化,故C错误;
D、在火力发电时,先将化学能转变为热能,然后热能转变为机械能,机械能最后转变为电能,故燃烧是使化学能转变为电能的关键,故D正确.
故选D.
点评 本题主要考查了煤的综合利用、能量的转化和食品添加剂等知识,难度不大,注意掌握食品添加剂的组成是解题的关键.

练习册系列答案
相关题目
10.硅及其化合物是带来人类文明的重要物质.下列说法正确的是( )
| A. | 陶瓷、水晶、水泥、玻璃都属于硅酸盐 | |
| B. | SiO2是非金属氧化物,它不与任何酸反应 | |
| C. | 可以用焦炭还原二氧化硅生产硅:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ | |
| D. | 高纯硅可用于制造光导纤维,高纯二氧化硅可用于制造太阳能电池 |
11.最简式相同,但既不是同系物,又不是同分异构体的是( )
| A. | 辛烯和1-丁烯 | B. | 苯和乙炔 | ||
| C. | 1-氯丙烷和2-氯丙烷 | D. | 甲基环己烷和乙烯 |
8.饮茶是中国人的传统饮食文化之一.为方便饮用,可通过以下方法制取罐装饮料茶:
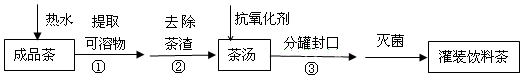
关于上述过程涉及的实验方法、实验操作和物质作用中说法不正确的是( )

关于上述过程涉及的实验方法、实验操作和物质作用中说法不正确的是( )
| A. | ①是萃取 | B. | ②是过滤 | ||
| C. | ③是分液 | D. | 维生素C可作抗氧化剂 |
15. 四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍.元素M与Z同周期,且原子半径是同周期中最大的.元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙.
四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍.元素M与Z同周期,且原子半径是同周期中最大的.元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙.
请按要求回答下列问题:
(1)X的单质的电子式: ;W最高价氧化物的水化物的化学式:HClO4.
;W最高价氧化物的水化物的化学式:HClO4.
(2)M、Z、W分别形成的简单离子的半径由大到小顺序为S2->Cl->Na+(填离子符号);写一个能说明元素W比元素Z的非金属性强的化学方程式:H2S+Cl2=S2↓+2HCl.
(3)甲变为乙的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(4)常温下,当用200mL 1mol•L-1的MOH溶液吸收4.48L(已折算为标准状况)ZY2时,所得溶液的主要溶质(填化学式)为NaHSO3;此时溶液pH<7,则其中含Z元素的几种粒子(忽略ZY2)的浓度由大到小的顺序为c(HSO3-)>c(SO32-)>c(H2SO3).
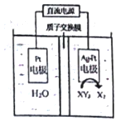
(5)工业上用电化学法治理酸性废液中的XY3-的原理如图示,其阴极的反应式为2NO3-+12H++10e-=N2↑+6H2O.
 四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍.元素M与Z同周期,且原子半径是同周期中最大的.元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙.
四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍.元素M与Z同周期,且原子半径是同周期中最大的.元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙.| X | Y | |
| Z | W |
(1)X的单质的电子式:
 ;W最高价氧化物的水化物的化学式:HClO4.
;W最高价氧化物的水化物的化学式:HClO4.(2)M、Z、W分别形成的简单离子的半径由大到小顺序为S2->Cl->Na+(填离子符号);写一个能说明元素W比元素Z的非金属性强的化学方程式:H2S+Cl2=S2↓+2HCl.
(3)甲变为乙的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(4)常温下,当用200mL 1mol•L-1的MOH溶液吸收4.48L(已折算为标准状况)ZY2时,所得溶液的主要溶质(填化学式)为NaHSO3;此时溶液pH<7,则其中含Z元素的几种粒子(忽略ZY2)的浓度由大到小的顺序为c(HSO3-)>c(SO32-)>c(H2SO3).
(5)工业上用电化学法治理酸性废液中的XY3-的原理如图示,其阴极的反应式为2NO3-+12H++10e-=N2↑+6H2O.
2.为倡导“节能减排”和“低碳经济”,目前工业上有一种方法是用CO2来生产燃料乙醇.一定条件下发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H<0.
(1)在一定条件下,在20L密闭容器中按物质的量比为1:3充入CO2和H2,温度在450K,n(H2)随时间变化如下表所示:
在450℃、0~1min,υ(CH3CH2OH)=0.0167mol/(L•min);此温度下该反应的化学平衡常数为6.22(结果保留三位有效数字).
(2)在5MPa下测得平衡体系中各物质的体积分数随温度的变化曲线如图所示:曲线乙表示的是CO2(填物质的化学式)的体积分数,图象中A点对应的体积分数b=18.8%(结果保留三位有效数字).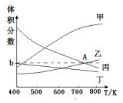
(3)下列措施中能使化学平衡向正反应方向移动的是BD
A.升高温度 B.将CH3CH2OH(g)及时液化抽出
C.选择高效催化剂 D.再充入l molCO2和3molH2
(4)25℃,1.01×105Pa时,9.2g液态乙醇完全燃烧,当恢复到原状态时,放出273.4kJ的热量,写出表示乙醇燃烧的热化学方程式:CH3CH2OH(l)+3O2(g)═CO2(g)+2H2O(l)△H=-1367kJ•mol-1.
(5)以石墨为电极,氢氧化钠、乙醇、水、氧气为原料,可以制成乙醇的燃料电池,写出发生还原反应的电极反应式:O2+2H2O+4e-═4OH?.
(1)在一定条件下,在20L密闭容器中按物质的量比为1:3充入CO2和H2,温度在450K,n(H2)随时间变化如下表所示:
| t/min | 0 | 1 | 3 | 5 |
| N(H2)/mol | 8 | 6 | 5 | 5 |
(2)在5MPa下测得平衡体系中各物质的体积分数随温度的变化曲线如图所示:曲线乙表示的是CO2(填物质的化学式)的体积分数,图象中A点对应的体积分数b=18.8%(结果保留三位有效数字).

(3)下列措施中能使化学平衡向正反应方向移动的是BD
A.升高温度 B.将CH3CH2OH(g)及时液化抽出
C.选择高效催化剂 D.再充入l molCO2和3molH2
(4)25℃,1.01×105Pa时,9.2g液态乙醇完全燃烧,当恢复到原状态时,放出273.4kJ的热量,写出表示乙醇燃烧的热化学方程式:CH3CH2OH(l)+3O2(g)═CO2(g)+2H2O(l)△H=-1367kJ•mol-1.
(5)以石墨为电极,氢氧化钠、乙醇、水、氧气为原料,可以制成乙醇的燃料电池,写出发生还原反应的电极反应式:O2+2H2O+4e-═4OH?.
19.设NA表示阿伏加德罗常数,下列叙述中不正确的是( )
| A. | 标准状况下,VL水含有的氧原子个数约为V/22.4 NA | |
| B. | 常温常压下,1 mol 碳烯( CH2)所含的电子总数为8NA | |
| C. | 标准状况下,含NA个氩原子的氩气体积约为22.4L | |
| D. | 1mol OH-参与电解,提供的电子数目为NA个 |

 .
.