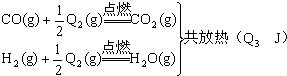题目内容
14.下列反应中氯元素全部被氧化的是D;全部被还原的是C,部分被氧化的是AB,部分被还原的是A.A.Cl2+H2O=HCl+HClOB.2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
C.2KClO3 $\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ D.2H2SO4+2KCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnSO4+K2SO4+Cl2↑+2H2O.
分析 Cl元素全部被氧化,则Cl失去电子,Cl元素的化合价升高,Cl元素全部被还原,则Cl得到电子,Cl元素的化合价降低,以此来解答.
解答 解:A.Cl2+H2O=HCl+HClO,该反应中Cl元素化合价由0价变为-1价、+1价,所以Cl元素部分被氧化部分被还原;
B.2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,该反应中部分Cl元素的化合价从-1价升高到0价,部分不变价,则Cl部分被氧化;
C.2KClO3 $\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑,该反应中Cl元素化合价由+5价变为-1价,所以氯元素得电子化合价降低,全部被还原;
D.2H2SO4+2KCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnSO4+K2SO4+Cl2↑+2H2O,该反应中Cl元素化合价由-1价变为0价,所以Cl元素失电子化合价升高,全部被氧化;
故答案为:D; C; A B; A.
点评 本题考查氧化还原反应,侧重考查基本概念,明确概念内涵是解本题关键,知道常见元素化合价.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
2.下列属于氧化还原反应的是( )
| A. | MgCl2+Ba(OH)2═BaCl2+Mg(OH)2↓ | B. | CO2+2NaOH═Na2CO3+H2O | ||
| C. | CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | H2+CuO $\frac{\underline{\;\;△\;\;}}{\;}$H2O+Cu |
6.下列根据实验现象所得出的结论不正确的是( )
| A. | 无色溶液使紫色石蕊试液变蓝;结论:溶液一定呈碱性 | |
| B. | 无色溶液焰色反应呈紫色(透过蓝色钴玻璃观察),结论:溶液中一定含有K+ | |
| C. | 在无色溶液中加入Na2CO3溶液产生白色沉淀;结论:溶液中一定含有Ca2+ | |
| D. | 在无色盐溶液中加入NaOH溶液,加热产生的气体使湿润的红色石蕊试纸变蓝;结论:溶液一定含有NH4+ |
4.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 78gNa2O2固体中阴离子的个数为2NA | |
| B. | 标准状况1.12L氯气与H2O反应,反应中转移的电子数为0.1NA | |
| C. | CO2通过Na2O2使其增重ag时,反应中转移的电子数为$\frac{a{N}_{A}}{56}$ | |
| D. | 60gSiO2含有的化学键数目为4NA |
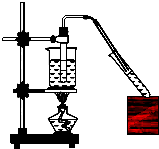 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯.