题目内容
4.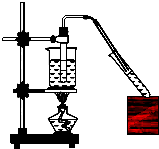 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯.(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:先在试管中加入一定量的乙醇,然后边加边振荡试管将浓硫酸慢慢加入试管,最最后再加入乙酸,然后轻轻振荡试管,使之混合均匀.
(2)装置中通蒸气的导管要插到饱和碳酸钠溶液液面上,而不能插入液面中,原因是:防止倒吸.
(3)饱和碳酸钠溶液的作用是吸收挥发的乙醇,与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度;浓硫酸的作用是:催化作用、吸水作用.
(4)乙酸乙酯密度比水小(填“小”或“大”),具有芳香气味的油状液体.
分析 (1)(1)制取乙酸乙酯时,先加乙醇,再加入浓硫酸,最后加乙酸;
(2)导管不能插入液面下的原因是防止倒吸;
(3)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;乙酸与乙醇在浓硫酸作用下加热发生酯化反应,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;
(4)产物乙酸乙酯在上层,所以密度比水小;根据乙酸乙酯的物理性质分析.
解答 解:(1)制取乙酸乙酯时,先加乙醇,再加入浓硫酸,最后加乙酸,方法为先在试管中加入一定量的乙醇,然后边加边振荡试管将浓硫酸慢慢加入试管,最最后再加入乙酸,
故答案为:先在试管中加入一定量的乙醇,然后边加边振荡试管将浓硫酸慢慢加入试管,最最后再加入乙酸;
(2)挥发出来的乙酸和乙醇易溶于碳酸钠溶液,所以导管不能插入液面下,原因是防止倒吸,
故答案为:防止倒吸;
(3)饱和碳酸钠溶液吸收挥发的乙醇,与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;乙酸与乙醇在浓硫酸作用下加热发生酯化反应,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;
故答案为:吸收挥发的乙醇,与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度;催化作用、吸水作用;
(4)产物乙酸乙酯在上层,所以密度比水小;乙酸乙酯具有芳香气味;
故答案为:小;芳香.
点评 本题考查乙酸乙酯的制备,解答时须注意酯化反应的原理和饱和碳酸钠溶液的作用,题目难度不大,侧重于考查学生的实验能力和对基础知识的应用能力.

练习册系列答案
相关题目
18.有Na2SO4、Fe2(SO4)3的混合溶液,已知其中Fe3+的物质的量浓度为0.3mol•L-1,SO42-的物质的量浓度为0.6mol•L-1,则此溶液中Na+的物质的量浓度为( )
| A. | 0.1 mol•L-1 | B. | 0.3 mol•L-1 | C. | 0.2 mol•L-1 | D. | 0.25 mol•L-1 |
19.下列有关物质用途的说法正确的是( )
| A. | 燃料的脱硫脱氮、SO2的回收利用和NOX的催化转化都是减少酸雨产生的措施 | |
| B. | 用FeCl2溶液与铜反应制作印刷电路板 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 碳酸钠治疗胃酸过多 |
9.下列说法正确的是( )
| A. | 按系统命名法 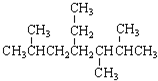 ,的名称为2,5,6-三甲基-4-乙基庚烷 ,的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖 | |
| D. | 苯酚为无色晶体,常因为氧化呈粉红色 |
16.ClO2是一种杀菌消毒效率高、二次污染小的水处理剂.实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法不正确的是( )
| A. | 反应中有3molH2C2O4被还原,转移6mol电子 | |
| B. | KClO3发生了还原反应 | |
| C. | KClO3的还原性强于CO2的还原性 | |
| D. | ClO2作水处理剂时,利用了其强氧化性 |
13.下列关于有机物的说法中,正确的是( )
| A. | 塑料、橡胶和纤维一定都是合成高分子材料 | |
| B. | 蔗糖不是高分子化合物,其水解产物能发生银镜反应 | |
| C. | 某烃类的混合气体跟Cl2混合光照,有油状液滴生成,说明混合气体肯定含有甲烷 | |
| D. |  分子中所有原子不可能都共平面. 分子中所有原子不可能都共平面. |
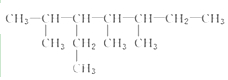 ;
;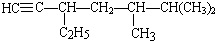 的系统名称为5,6-二甲基-3-乙基-1-庚烯,将其在催化剂存在条件下完全氢化,所得烷烃的系统名称为2,3-二甲基-5-乙基-庚烷.
的系统名称为5,6-二甲基-3-乙基-1-庚烯,将其在催化剂存在条件下完全氢化,所得烷烃的系统名称为2,3-二甲基-5-乙基-庚烷.