题目内容
下列关于电解质溶液的叙述正确是( )
| A、在pH=12的溶液中,K+、Cl-、HCO3-、Na+可以大量共存 |
| B、在pH=0的溶液中,Na+、NO3-、SO32-、K+可以大量共存 |
| C、分别与等物质的量的HCl和CH3COOH反应时,消耗NaOH的物质的量相同 |
| D、由0.1 mol/L一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH- |
考点:离子共存问题,pH的简单计算
专题:离子反应专题,电离平衡与溶液的pH专题
分析:A.pH=12的溶液,显碱性;
B.pH=0的溶液,显酸性;
C.等物质的量的HCl和CH3COOH,消耗碱相同;
D.0.1 mol/L一元碱BOH溶液的pH=10,则BOH为弱碱,存在电离平衡.
B.pH=0的溶液,显酸性;
C.等物质的量的HCl和CH3COOH,消耗碱相同;
D.0.1 mol/L一元碱BOH溶液的pH=10,则BOH为弱碱,存在电离平衡.
解答:
解:A.pH=12的溶液,显碱性,OH-、HCO3-结合生成水和碳酸根离子,不能大量共存,故A不选;
B.pH=0的溶液,显酸性,NO3-、SO32-、H+发生氧化还原反应,不能大量共存,故B不选;
C.等物质的量的HCl和CH3COOH,消耗碱相同,则消耗NaOH的物质的量相同,故C选;
D.0.1 mol/L一元碱BOH溶液的pH=10,则BOH为弱碱,存在电离平衡,则BOH?B++OH-,故D错误;
故选C.
B.pH=0的溶液,显酸性,NO3-、SO32-、H+发生氧化还原反应,不能大量共存,故B不选;
C.等物质的量的HCl和CH3COOH,消耗碱相同,则消耗NaOH的物质的量相同,故C选;
D.0.1 mol/L一元碱BOH溶液的pH=10,则BOH为弱碱,存在电离平衡,则BOH?B++OH-,故D错误;
故选C.
点评:本题考查离子的共存、pH的计算,为高频考点,把握常见离子的反应为解答的关键,侧重氧化还原反应、复分解反应及酸碱中和的离子反应考查,题目难度不大.

练习册系列答案
相关题目
下列过程或事实不涉及氧化还原反应的是( )
①蔗糖炭化 ②用氢氟酸雕刻玻璃 ③铁遇冷的浓硫酸钝化 ④装碱液的试剂瓶不用玻璃塞 ⑤雷雨发庄稼 ⑥实际使用的浓硝酸显黄色.
①蔗糖炭化 ②用氢氟酸雕刻玻璃 ③铁遇冷的浓硫酸钝化 ④装碱液的试剂瓶不用玻璃塞 ⑤雷雨发庄稼 ⑥实际使用的浓硝酸显黄色.
| A、①③⑤⑥ | B、②④ |
| C、②③④⑥ | D、①②③④⑤⑥ |
已知将液溴滴入热的NaOH浓溶液中,发生如下氧化还原反应:3Br2+6NaOH=5NaBr+NaBrO3+3H2O,氧化剂和还原剂的物质的量之比正确的是( )
| A、.1:2 | B、.1:5 |
| C、.5:1 | D、2:1 |
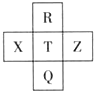 五种元素在元素周期表中的相对位置如图所示,其中非金属元素X的单质是淡黄色晶体.下列判断不正确的是( )
五种元素在元素周期表中的相对位置如图所示,其中非金属元素X的单质是淡黄色晶体.下列判断不正确的是( )| A、Z为Cl |
| B、非金属性:X<T |
| C、原子半径:R<T<Q |
| D、最高价氧化物的水化物的酸性:T>Q |
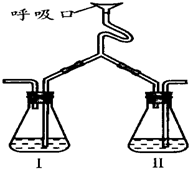 为验证人体呼出气体中含有的CO2不是来自空气,而是人体代谢作用产生的.某学校学生课外活动小组设计了如图所示装置(备注:通过呼吸口慢吸慢呼来实现),你认为该装置应选用的试剂是( )
为验证人体呼出气体中含有的CO2不是来自空气,而是人体代谢作用产生的.某学校学生课外活动小组设计了如图所示装置(备注:通过呼吸口慢吸慢呼来实现),你认为该装置应选用的试剂是( )
 (1)电镀时,镀件与电源的
(1)电镀时,镀件与电源的
 有如图实验装置,其中a、b、c为弹簧夹.
有如图实验装置,其中a、b、c为弹簧夹.