题目内容
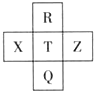 五种元素在元素周期表中的相对位置如图所示,其中非金属元素X的单质是淡黄色晶体.下列判断不正确的是( )
五种元素在元素周期表中的相对位置如图所示,其中非金属元素X的单质是淡黄色晶体.下列判断不正确的是( )| A、Z为Cl |
| B、非金属性:X<T |
| C、原子半径:R<T<Q |
| D、最高价氧化物的水化物的酸性:T>Q |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:非金属元素X的单质是淡黄色晶体,则X是S元素,根据五种元素在元素周期表中的相对位置,则R是F元素、T是Cl元素、A是Ar元素、Q是Br元素,
A.根据元素在周期表中的位置确定Z元素;
B.同一周期元素中,元素的非金属性随着原子序数的增大而增强;
C.同一主族元素中,元素原子半径随着原子序数的增大而增大;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强.
A.根据元素在周期表中的位置确定Z元素;
B.同一周期元素中,元素的非金属性随着原子序数的增大而增强;
C.同一主族元素中,元素原子半径随着原子序数的增大而增大;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答:
解:非金属元素X的单质是淡黄色晶体,则X是S元素,根据五种元素在元素周期表中的相对位置,则R是F元素、T是Cl元素、Z是Ar元素、Q是Br元素,
A.根据以上分析知,Z是Ar元素,故A错误;
B.同一周期元素中,元素的非金属性随着原子序数的增大而增强,所以非金属性X<T,故B正确;
C.同一主族元素中,元素原子半径随着原子序数的增大而增大,所以原子半径R<T<Q,故C正确;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,元素非金属性T>Q,所以最高价氧化物的水化物的酸性:T>Q,故D正确;
故选A.
A.根据以上分析知,Z是Ar元素,故A错误;
B.同一周期元素中,元素的非金属性随着原子序数的增大而增强,所以非金属性X<T,故B正确;
C.同一主族元素中,元素原子半径随着原子序数的增大而增大,所以原子半径R<T<Q,故C正确;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,元素非金属性T>Q,所以最高价氧化物的水化物的酸性:T>Q,故D正确;
故选A.
点评:本题考查了元素周期表和元素周期律的综合应用,明确元素非金属性与其最高价氧化物是水化物酸性强弱的关系、原子半径规律等知识点即可解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、11.2LSO3中含有氧原子数为1.5NA |
| B、1 mol氯气和足量NaOH溶液反应转移电子数为2 NA |
| C、N2O4和NO2组成的46g混合气体中含有2NA个氧原子 |
| D、0.1mol/L的NH4NO3溶液中含氮原子数目为0.2NA |
已知:Ⅰ.断裂1mol N-N键吸收167kJ热量,形成1mol N≡N键放出942kJ热量,Ⅱ.N2 (g)+3H2(g)2NH3(g);△H1=-92.2kJ?mol-1对于反应:N4 (g)+6H2 (g)4NH3(g);△H2(kJ?mol-1),以下说法正确的是( )
| A、该反应的反应热△H2>0 |
| B、N2分子比 N4分子更稳定 |
| C、△H2=2△H1 |
| D、△H2与方程式系数无关 |
考古时可利用146C测定一些文物的年代.146C中的“14”是指碳原子中的( )
| A、质子数 | B、中子数 |
| C、电子数 | D、质量数 |
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
| R | ||
| X | T | Z |
| Q |
| A、非金属性:Z<T<X |
| B、R与Q的电子数相差26 |
| C、气态氢化物稳定性:R<T<Q |
| D、最高价氧化物的水化物的酸性:T<Q |
下列有关氧化还原反应的叙述中正确的是( )
| A、化合反应都不是氧化还原反应 |
| B、氧化还原反应的本质是元素化合价的升降 |
| C、失电子的反应物在反应中作氧化剂,反应中被还原 |
| D、金属单质在化学反应中一定做还原剂 |
下列关于电解质溶液的叙述正确是( )
| A、在pH=12的溶液中,K+、Cl-、HCO3-、Na+可以大量共存 |
| B、在pH=0的溶液中,Na+、NO3-、SO32-、K+可以大量共存 |
| C、分别与等物质的量的HCl和CH3COOH反应时,消耗NaOH的物质的量相同 |
| D、由0.1 mol/L一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH- |
 煅烧过程存在以下反应:
煅烧过程存在以下反应: