题目内容
煅烧硫铁矿石(主要成分是FeS2),可获得制取硫酸所需的SO2,反应的化学方程式为:
4FeS2+11O2
2Fe2O3+8SO2
(1)以1mol FeS2为原料,可制得SO2 mol,参加反应的氧气有 L;
(2)已知工业上用过量氨水吸收制硫酸的尾气中二氧化硫,发生反应的化学方程式:
2NH3+SO2+H2O═(NH4)2SO3
若某工厂每天产生的尾气中SO2体积百分含量为0.5%,则1m3的尾气(已换算成标准状况),可以产生多少克(NH4)2SO3?若使用50mL 12mol/L的氨水吸收,求反应结束后,剩余氨水的物质的量浓度?(假设溶液体积不发生变化)
4FeS2+11O2
| ||
(1)以1mol FeS2为原料,可制得SO2
(2)已知工业上用过量氨水吸收制硫酸的尾气中二氧化硫,发生反应的化学方程式:
2NH3+SO2+H2O═(NH4)2SO3
若某工厂每天产生的尾气中SO2体积百分含量为0.5%,则1m3的尾气(已换算成标准状况),可以产生多少克(NH4)2SO3?若使用50mL 12mol/L的氨水吸收,求反应结束后,剩余氨水的物质的量浓度?(假设溶液体积不发生变化)
考点:含硫物质的性质及综合应用,化学方程式的有关计算
专题:氧族元素
分析:(1)根据反应方程式计算;根据方程式求出氧气的物质的量,再由V=n?Vm计算;
(2)根据尾气中二氧化硫的含量求出1m3的尾气二氧化硫的量,再根据方程式计算出(NH4)2SO3;求先求出总的氨气的物质的量,减去消耗的氨气即是剩余的氨气,再求其浓度.
(2)根据尾气中二氧化硫的含量求出1m3的尾气二氧化硫的量,再根据方程式计算出(NH4)2SO3;求先求出总的氨气的物质的量,减去消耗的氨气即是剩余的氨气,再求其浓度.
解答:
解:(1)已知4FeS2+11O2
2Fe2O3+8SO2,1mol FeS2为原料生成的二氧化硫为2mol,消耗氧气为
mol,则氧气的体积为V=n?Vm=
mol×22.4L/mol=61.6L;
故答案为:2;61.6;
(2)已知工厂每天产生的尾气中SO2体积百分含量为0.5%,则1m3的尾气中二氧化硫为:n(SO2)=
=
=0.2232mol,
已知2NH3+SO2+H2O═(NH4)2SO3,则生成的(NH4)2SO3为0.2232mol,其质量为:m=nM=0.2232mol×116g/mol=25.9g;
若使用50mL 12mol/L的氨水吸收,则总的氨气为n=cV=0.05L×12mol/L=0.6mol,反应消耗的氨气为0.2232mol×2=0.4464mol,
所以剩余的氨气为0.6mol-0.4464mol=0.1536mol,则剩余氨水的物质的量浓度为c=
=
≈3mol/L;
答:则1m3的尾气(已换算成标准状况),可以产生25.9g克(NH4)2SO3;剩余氨水的物质的量浓度为3mol/L.
| ||
| 11 |
| 4 |
| 11 |
| 4 |
故答案为:2;61.6;
(2)已知工厂每天产生的尾气中SO2体积百分含量为0.5%,则1m3的尾气中二氧化硫为:n(SO2)=
| V |
| Vm |
| 1×103L×0.5% |
| 22.4L/mol |
已知2NH3+SO2+H2O═(NH4)2SO3,则生成的(NH4)2SO3为0.2232mol,其质量为:m=nM=0.2232mol×116g/mol=25.9g;
若使用50mL 12mol/L的氨水吸收,则总的氨气为n=cV=0.05L×12mol/L=0.6mol,反应消耗的氨气为0.2232mol×2=0.4464mol,
所以剩余的氨气为0.6mol-0.4464mol=0.1536mol,则剩余氨水的物质的量浓度为c=
| n |
| V |
| 0.1536mol |
| 0.05L |
答:则1m3的尾气(已换算成标准状况),可以产生25.9g克(NH4)2SO3;剩余氨水的物质的量浓度为3mol/L.
点评:本题考查了硫的化合物的性质及有关方程式的计算,侧重于考查学生的计算能力,题目难度中等.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
下列分子中所有的原子的最外层均是8个电子的是( )
| A、BeCl2 |
| B、BCl3 |
| C、CH4 |
| D、SiCl4 |
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
| R | ||
| X | T | Z |
| Q |
| A、非金属性:Z<T<X |
| B、R与Q的电子数相差26 |
| C、气态氢化物稳定性:R<T<Q |
| D、最高价氧化物的水化物的酸性:T<Q |
下列关于电解质溶液的叙述正确是( )
| A、在pH=12的溶液中,K+、Cl-、HCO3-、Na+可以大量共存 |
| B、在pH=0的溶液中,Na+、NO3-、SO32-、K+可以大量共存 |
| C、分别与等物质的量的HCl和CH3COOH反应时,消耗NaOH的物质的量相同 |
| D、由0.1 mol/L一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH- |
已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:NaCN+HNO2→HCN+NaNO2 NaCN+HF→HCN+NaF NaNO2+HF→HNO2+NaF,由此可判断下列叙述不正确的是( )
| A、K(HF)=7.2×10-4 |
| B、K(HNO2)=4.9×10-10 |
| C、必须根据其中三个反应才可得出结论 |
| D、K(HCN)<K(HNO2)<K(HF) |
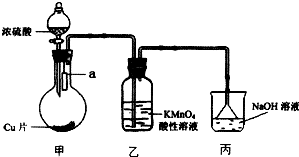 实验室可用如图装置(加热装置略)制取SO2以及验证SO2性质.
实验室可用如图装置(加热装置略)制取SO2以及验证SO2性质. 煅烧过程存在以下反应:
煅烧过程存在以下反应: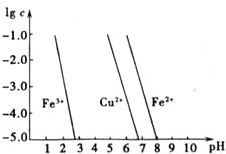 如图横坐标为溶液pH,纵坐标为金属离子物质的量浓度的对数值(当溶液中金属离子浓度≤10-5mol?L-1时,可认为沉淀完全),试回答:
如图横坐标为溶液pH,纵坐标为金属离子物质的量浓度的对数值(当溶液中金属离子浓度≤10-5mol?L-1时,可认为沉淀完全),试回答: