题目内容
 (1)电镀时,镀件与电源的
(1)电镀时,镀件与电源的(2)化学镀的原理是利用化学反应生成金属单质沉淀在镀件表面形成镀层.
①若用铜盐进行化学镀铜,应选用
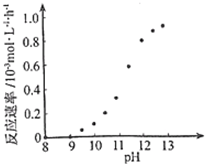
②某化学镀铜的反应速率随镀液pH变化如图所示.该镀铜过程中,镀液pH控制在12.5左右.据图中信息,给出使反应停止的方法
(3)酸浸法制取硫酸铜的流程示意图如下:
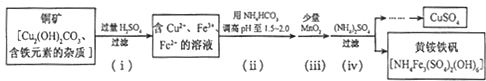
①步骤(i)中Cu2(OH)2CO3发生反应的化学方程式为
②步骤(ii)所加试剂起调节pH作用的离子是
③在步骤(iii)发生的反应中,1mol MnO2转移2mol电子,该反应的离子方程式为
④步骤(iv)除去杂质的化学方程式可表示为
3Fe3++NH4++2SO42-+6H2O═NH4Fe3(SO4)2(OH)6↓+6H+
过滤后母液的pH=2.0,c(Fe3+)=a mol?L-1,c(NH4+)=b mol?L-1,c(SO42-)=d mol?L-1,该反应的平衡常数K=
考点:电解原理,制备实验方案的设计
专题:实验设计题,电化学专题
分析:(1)电镀时,镀件就是待镀金属,作阴极与电源的负极相连,电解质溶液中含有铜离子的盐溶液;
(2)①用铜盐进行化学镀铜,铜离子在阴极得电子,应选还原剂发生反应;
②镀铜过程中,镀液pH 控制在12.5左右,结合图可知,pH=8-9之间,反应速率为0来解答;
(3)①碱式碳酸铜与硫酸反应生成硫酸铜、二氧化碳和水;
②硫酸氢铵加入溶液中调节溶液PH是为了和i步骤中加入的过量硫酸反应同时提高溶液PH利于除去铁离子;铵根离子不反应,所以是碳酸氢根离子;
③二氧化锰是强氧化剂,可以和亚铁离子发生氧化还原反应,亚铁离子被氧化为铁离子;
④依据平衡常数的概念计算,用生成物浓度的幂次方乘积除以反应物浓度的幂次方乘积.
(2)①用铜盐进行化学镀铜,铜离子在阴极得电子,应选还原剂发生反应;
②镀铜过程中,镀液pH 控制在12.5左右,结合图可知,pH=8-9之间,反应速率为0来解答;
(3)①碱式碳酸铜与硫酸反应生成硫酸铜、二氧化碳和水;
②硫酸氢铵加入溶液中调节溶液PH是为了和i步骤中加入的过量硫酸反应同时提高溶液PH利于除去铁离子;铵根离子不反应,所以是碳酸氢根离子;
③二氧化锰是强氧化剂,可以和亚铁离子发生氧化还原反应,亚铁离子被氧化为铁离子;
④依据平衡常数的概念计算,用生成物浓度的幂次方乘积除以反应物浓度的幂次方乘积.
解答:
解;(1)电镀时,镀件就是待镀金属,作阴极与电源的负极相连,电解质溶液中含有铜离子的盐溶液,故答案为:负; CuSO4;
(2)①要把铜从铜盐中置换铜出来,铜离子在阴极得电子,如用铁作还原剂即可,所以加入还原剂,故答案为:还原剂;
②根据图示信息,pH=8-9之间,反应速率为0,所以要使反应停止,调节溶液的pH至8-9 之间,故答案为:调节溶液的pH至8-9 之间;
(3)①碱式碳酸铜与硫酸反应的方程式直接写,用观察法配平.Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O,
故答案为:Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O;
②题目要求调高PH,铵根离子显酸性,碳酸氢根离子显碱性,则起作用的离子是碳酸氢根离子,故答案为;HCO3-;
③依题意亚铁离子变成了铁离子,1mol MnO2转移电子2 mol,则锰元素从+4变成+2价,溶液是显酸性的,方程式经过观察可要补上氢离子,综合上述分析可写出离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
④除去杂质的化学方程式可表示为:3Fe3++NH4++2SO42-+6H2O=NH4Fe3 (SO4)2(OH)6+6H+;过滤后母液的pH=2.0,c(Fe3+)=a mol?L-1,c( NH4+)=b mol?L-1,c( SO42-)=d mol?L-1,氢离子浓度为10-2,依据K的表达式写出K=
=
,
故答案为:
.
(2)①要把铜从铜盐中置换铜出来,铜离子在阴极得电子,如用铁作还原剂即可,所以加入还原剂,故答案为:还原剂;
②根据图示信息,pH=8-9之间,反应速率为0,所以要使反应停止,调节溶液的pH至8-9 之间,故答案为:调节溶液的pH至8-9 之间;
(3)①碱式碳酸铜与硫酸反应的方程式直接写,用观察法配平.Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O,
故答案为:Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O;
②题目要求调高PH,铵根离子显酸性,碳酸氢根离子显碱性,则起作用的离子是碳酸氢根离子,故答案为;HCO3-;
③依题意亚铁离子变成了铁离子,1mol MnO2转移电子2 mol,则锰元素从+4变成+2价,溶液是显酸性的,方程式经过观察可要补上氢离子,综合上述分析可写出离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
④除去杂质的化学方程式可表示为:3Fe3++NH4++2SO42-+6H2O=NH4Fe3 (SO4)2(OH)6+6H+;过滤后母液的pH=2.0,c(Fe3+)=a mol?L-1,c( NH4+)=b mol?L-1,c( SO42-)=d mol?L-1,氢离子浓度为10-2,依据K的表达式写出K=
| c6(H+) |
| c2(SO42-)c3(Fe3+)c(NH4+) |
| 10-12 |
| a3bd2 |
故答案为:
| 10-12 |
| a3bd2 |
点评:本题考查电解原理,熟悉电镀及明确读图信息的重要性是解答本题的关键,还考查了艺流程的分析判断,物质分离的方法和试剂选择方法,离子方程式的书写,氧化还原反应的分析判断,平衡常数的计算,没有在流程上设置障碍,问题设计平实,难度不大.平衡常数计算简单,只要代入即可,没有复杂的数学变换,降低了难度.对图中信息的获取要求较高.

练习册系列答案
相关题目
已知:Ⅰ.断裂1mol N-N键吸收167kJ热量,形成1mol N≡N键放出942kJ热量,Ⅱ.N2 (g)+3H2(g)2NH3(g);△H1=-92.2kJ?mol-1对于反应:N4 (g)+6H2 (g)4NH3(g);△H2(kJ?mol-1),以下说法正确的是( )
| A、该反应的反应热△H2>0 |
| B、N2分子比 N4分子更稳定 |
| C、△H2=2△H1 |
| D、△H2与方程式系数无关 |
下列关于电解质溶液的叙述正确是( )
| A、在pH=12的溶液中,K+、Cl-、HCO3-、Na+可以大量共存 |
| B、在pH=0的溶液中,Na+、NO3-、SO32-、K+可以大量共存 |
| C、分别与等物质的量的HCl和CH3COOH反应时,消耗NaOH的物质的量相同 |
| D、由0.1 mol/L一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH- |
燃料电池是一种新型电池,它主要是利用燃料在燃烧过程中把化学能直接转化为电能.氢氧燃料电池的基本反应如下,X极:2O2(g)+2H2O(l)+4e-=4OH-;Y极:2H2(g)+4OH--4e-=4H2O (l).下列判断正确的是( )
| A、X是正极 |
| B、Y是正极 |
| C、Y极发生还原反应 |
| D、X极发生氧化反应 |
 煅烧过程存在以下反应:
煅烧过程存在以下反应: 如图横坐标为溶液pH,纵坐标为金属离子物质的量浓度的对数值(当溶液中金属离子浓度≤10-5mol?L-1时,可认为沉淀完全),试回答:
如图横坐标为溶液pH,纵坐标为金属离子物质的量浓度的对数值(当溶液中金属离子浓度≤10-5mol?L-1时,可认为沉淀完全),试回答: R可以被KMnO4的酸性溶液氧化生成
R可以被KMnO4的酸性溶液氧化生成 COOH,但若烷基R中直接与苯环连接的碳原子上没有C一H键,则不容易被氧化得到
COOH,但若烷基R中直接与苯环连接的碳原子上没有C一H键,则不容易被氧化得到 COOH.
COOH. COOH的异构体共有7种,其中的3种是
COOH的异构体共有7种,其中的3种是 CH2CH2CH2CH2CH3,
CH2CH2CH2CH2CH3, ,
, ,写出其他4种的结构简式:
,写出其他4种的结构简式:
