题目内容
4. Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.Ⅰ.制备Na2S2O3•5H2O
反应原理:Na2SO3(aq)+S(s)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80mL蒸馏水.另取5g研细的硫粉,用3mL乙醇润湿,加入上述溶液中.
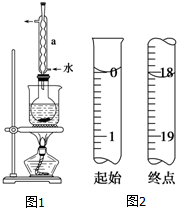
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60分钟.
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3•5H2O,经过滤、洗涤、干燥,得到产品.
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是使硫粉易于分散到溶液中.
(2)仪器a的名称是冷凝管,其作用是冷凝回流.
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是Na2SO4.检验是否存在该杂质的方法是
取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4.
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:S2O32?+2H+=S↓+SO2↑+H2O.
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0mol•L-1碘的标准溶液滴定.
反应原理为2S2O${\;}_{3}^{2-}$+I2═S4O${\;}_{6}^{2-}$+2I-
(5)滴定至终点时,溶液颜色的变化:由无色变为蓝色.
(6)测定起始和终点的液面位置如图2,则消耗碘的标准溶液体积为18.10mL.产品的纯度为(设Na2S2O3•5H2O相对分子质量为M)$\frac{3.620×1{0}^{-13}M}{W}$×100%.
Ⅲ.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO${\;}_{4}^{2-}$,常用作脱氯剂,该反应的离子方程式为
S2O32?+4Cl2+5H2O=2SO42?+8Cl?+10H+.
分析 (1)硫粉难溶于水、微溶于乙醇,乙醇湿润可以使硫粉易于分散到溶液中;
(2)根据图示装置中仪器构造写出其名称,然后根据冷凝管能够起到冷凝回流的作用进行解答;
(3)由于S2O32?具有还原性,易被氧气氧化成硫酸根离子可知杂质为硫酸钠;根据检验硫酸根离子的方法检验杂质硫酸钠;
(4)S2O32?与氢离子在溶液中能够发生氧化还原反应生成硫单质,据此写出反应的离子方程式;
(5)根据滴定前溶液为无色,滴定结束后,碘单质使淀粉变蓝,判断达到终点时溶液颜色变化;
(6)根据图示的滴定管中液面读出初读数、终读数,然后计算出消耗碘的标准溶液体积;根据反应2S2O32-+I2═S4O62-+2I-可知,n(S2O32-)=2n(I2),然后根据题中碘单质的物质的量计算出Na2S2O3•5H2O质量及产品的纯度;
(7)根据题干信息“Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-”及化合价升降相等写出反应的离子方程式.
解答 解:(1)硫粉难溶于水微溶于乙醇,所以硫粉在反应前用乙醇湿润是使硫粉易于分散到溶液中,
故答案为:使硫粉易于分散到溶液中;
(2)根据题中图示装置图可知,仪器a为冷凝管,该实验中冷凝管具有冷凝回流的作用,
故答案为:冷凝管;冷凝回流;
(3)S2O32?具有还原性,能够被氧气氧化成硫酸根离子,所以可能存在的杂质是硫酸钠;检验硫酸钠的方法为:取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4,
故答案为:Na2SO4;取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4;
(4)S2O32?与氢离子发生氧化还原反应生成淡黄色硫单质,反应的离子方程式为:S2O32?+2H+=S↓+SO2↑+H2O,
故答案为:S2O32?+2H+=S↓+SO2↑+H2O;
(5)滴定结束后,碘单质使淀粉变蓝,所以滴定终点时溶液颜色变化为:由无色变为蓝色,
故答案为:由无色变为蓝色;
(6)根据图示的滴定管中液面可知,滴定管中初始读数为0,滴定终点液面读数为18.10mL,所以消耗碘的标准溶液体积为18.10mL;
根据反应2S2O32-+I2═S4O62-+2I-可知,n(S2O32-)=2n(I2),所以W g产品中含有Na2S2O3•5H2O质量为:0.1000 mol•L-1×18.10×10-3L×2×M=3.620×10-3Mg,则产品的纯度为:$\frac{3.620×1{0}^{-3}Mg}{Wg}$×100%=$\frac{3.620×1{0}^{-13}M}{W}$×100%,
故答案为:18.10;$\frac{3.620×1{0}^{-13}M}{W}$×100%;
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,根据化合价升降相等配平后的离子方程式为:S2O32?+4Cl2+5H2O=2SO42?+8Cl?+10H+,
故答案为:S2O32?+4Cl2+5H2O=2SO42?+8Cl?+10H+.
点评 本题考查了化学实验基本操作方法及常见仪器的构造、离子的检验方法、中和滴定、离子方程式的书写等知识,题目难度较大,试题涉及的题量较大,知识点较多,充分考查了学生对所学知识的掌握情况,注意中和滴定操作规范性.


| A. | 碳表面发生氧化反应 | |
| B. | 钢铁被腐蚀的最终产物为FeO | |
| C. | 生活中钢铁制品的腐蚀以图①所示为主 | |
| D. | 图②中,正极反应式为O2+4e-+2H2O═4OH- |
| A. | 聚丙烯的结构简式: | B. | 丙烷分子的比例模型: | ||
| C. | 2-乙基-1,3-丁二烯分子的键线: | D. | 四氯化碳分子的电子式: |
| Y | V | |||
| X | W |
下列判断正确的是( )
| A. | 原子半径:X>Y>V>W | |
| B. | X、W的质子数之和与最外层电子数之和的比值为 2:1 | |
| C. | 甲、乙混合时所生成的白烟为离子化合物,但其中含有共价键 | |
| D. | 在足量的沸水中滴入含有16.25 g ZW3的溶液可得到0.1 mol Z(OH)3 |
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3-OH- Cl- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸酸化的硝酸钡溶液,只有A中放出无色气体,只有D中产生白色沉淀;
⑤将B、C两溶液混合,未见沉淀或气体生成.根据上述实验填空:
(1)写出B、D的化学式:BKCl,DCuSO4.
(2)C可用作净水剂,用离子方程式表示其净水原理Al3++3H2O?Al(OH)3(胶体)+3H+.
(3)将含0.01mol A的溶液与含0.02mol E的溶液反应后,向溶液中滴加0.1mol•L-1稀盐酸.下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是C

(4)在m mL b mol•L-1 C溶液中,加入等体积a mol•L-1 的E溶液.当a≤3b时,生成沉淀的物质的量是$\frac{ma}{3}$×10-3 mol;当3b<a<4b件时,生成沉淀的物质的量是(4mb-ma)×10-3mol.
| A. | pH=2的醋酸溶液与pH=12的氢氧化钠溶液等体积混合,混合后溶液pH=7 | |
| B. | 将0.1mol•L-1氢氧化钠溶液与pH=1稀硫酸等体积混合,混合后的溶液pH<7 | |
| C. | 硫酸铵溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | pH相同的醋酸钠溶液、碳酸氢钠溶液、碳酸钠溶液,其物质的量浓度: c(CH3COONa)>c(NaHCO3)>c(Na2CO3) |
 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题: