题目内容
15.下列化学用语正确的是( )| A. | 聚丙烯的结构简式: | B. | 丙烷分子的比例模型: | ||
| C. | 2-乙基-1,3-丁二烯分子的键线: | D. | 四氯化碳分子的电子式: |
分析 A.丙烯不饱和的C=C双键其中一个键断开,自身加成反应生成聚丙烯,聚丙烯结构单元主链含有2个C原子,;
B.图中模型为丙烷的球棍模型,比例模型表示原子的比例大小、原子连接顺序、空间结构,不能表示成键情况;
C.键线式用短线表示化学键,C原子、H原子不标出,交点、端点是碳原子,利用H原子饱和碳的四价结构,杂原子及杂原子上氢原子需标出;
D.氯原子未成键的孤对电子对未画出.
解答 解:A.聚丙烯的结构简式为 ,故A错误;
,故A错误;
B.图中模型为丙烷的球棍模型,故B错误,
C.键线式用短线表示化学键,交点、端点是碳原子,C原子、H原子不标出,故2-乙基-1,3-丁二烯分子的键线式为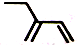 ,故C正确;
,故C正确;
D.氯原子未成键的孤对电子对未画出,分子中碳原子与氯原子之间形成1对共用电子对,电子式为 ,故D错误;
,故D错误;
故选C.
点评 本题考查常用化学用语的书写,难度中等,注意电子式书写中未成键的孤对电子容易忽略.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.一定条件的密闭容器中:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905.9kJ•mol-1,下列叙述不正确 的是( )
| A. | NH3与O2起始时物质的量之比等于4:5,则平衡后两物质的转化率一定相等 | |
| B. | 平衡时4v正(O2)=5v逆(NO) | |
| C. | 平衡后降压,混合气体平均摩尔质量减小 | |
| D. | 达到平衡时放出热量为905.9 kJ,则起始时投入4mol NH3和5mol O2 |
6.下列实验操作中不正确的是( )
| A. | 定容时,如果加水超过了刻度线,则可用胶头滴管吸出多余部分 | |
| B. | 蒸馏时,应将温度计水银球置于蒸馏烧瓶支管口处 | |
| C. | 分液时,下层液体从分液漏斗下口流出,上层液体应从分液漏斗上口倒出 | |
| D. | 称量NaOH 时,NaOH 置于小烧杯中放在托盘天平左盘,砝码放在右盘 |
3.下列说法中,正确的是( )
| A. | 向某溶液中加入氨水,产生白色沉淀,证明原溶液中存在Al3+ | |
| B. | 向某溶液中加入NaOH并加热,产生可使湿润红色石蕊试纸变蓝的气体,则原溶液中有NH4+ | |
| C. | 向某溶液中加入Ba(NO3)2溶液,产生白色沉淀,加入稀硝酸沉淀不溶解,则原溶液中有SO42- | |
| D. | 向某溶液中加入AgNO3溶液,产生白色沉淀,则原溶液中有Cl- |
10.下列各组离子以适当比例混合,可以形成无色透明碱性溶液的是( )
| A. | Na+、Ba2+、OH-、SO42- | B. | Ag+、NH4+、OH-、NO3- | ||
| C. | Mg2+、Na+、AlO2-、OH- | D. | MnO4-、Al3+、SO42-、Cl- |
5.把amolCO2气体通入含bmolCa(OH)2的澄清石灰水中,生成cg沉淀,c值不可能是( )
| A. | 100(2a-b) | B. | 100(2b-a) | C. | 100a | D. | 100b |

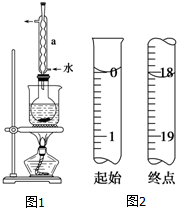 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.