��Ŀ����
����±��ش��������⣨��Ϊ�����µ����ݣ���
��1�������������У�������ǿ���� ��
��2���ڳ����£���ͬ���ʵ���Ũ�ȵĢ�CH3COONa����Na2CO3����NaClO������Һ��pH��С�����˳��Ϊ ��������Żش�
��3�����һ���������ԡ���������ʵ�鷽��֤��CH3COOH����ǿ��̼�ᣨ�������������;�������� ��
��4����Na2CO3��Һ��ͨ�����������Ƶ�ij�������������г��õ�Ư�ס����������Σ�ͬʱ�����������������ɣ��÷�Ӧ�Ļ�ѧ����ʽΪ ��
��5��ʵ��֤������0.01mol/L NaAlO2��Һ�м�������0.01mol/L NaHCO3��Һ���������ɫ��״�������ݴ��ƶ�CO32-��AlO2-���������У�������ӣ�H+��������ǿ���� ��
| �� | ���볣����Ka�� | �� | ���볣����Ka�� |
| CH3COOH | 1.8��10-5 | H2CO3 | K1=4.4��10-7 K2=4.7��10-11 |
| HClO | 3��10-8 |
��2���ڳ����£���ͬ���ʵ���Ũ�ȵĢ�CH3COONa����Na2CO3����NaClO������Һ��pH��С�����˳��Ϊ
��3�����һ���������ԡ���������ʵ�鷽��֤��CH3COOH����ǿ��̼�ᣨ�������������;��������
��4����Na2CO3��Һ��ͨ�����������Ƶ�ij�������������г��õ�Ư�ס����������Σ�ͬʱ�����������������ɣ��÷�Ӧ�Ļ�ѧ����ʽΪ
��5��ʵ��֤������0.01mol/L NaAlO2��Һ�м�������0.01mol/L NaHCO3��Һ���������ɫ��״�������ݴ��ƶ�CO32-��AlO2-���������У�������ӣ�H+��������ǿ����
���㣺���������ˮ��Һ�еĵ���ƽ��,����ˮ���Ӧ��
ר�⣺����ƽ������Һ��pHר��,�����ˮ��ר��
��������1����ͬ�¶��£���ĵ���ƽ�ⳣ��Խ��������Խǿ��
��2����ͬ�¶��£����ǿ�������ǣ�CH3COOH��H2CO3��HClO��HCO3-���������ˮ��̶ȴ�С˳���ǣ�CO32-��ClO-��HCO3-��CH3COO-����ͬŨ�ȵ�������Һ�У��������ˮ��̶�Խ������Һ��pHԽ��
��3��ǿ���ܺ�������η�Ӧ�������
��4��������ˮ��Ӧ����HCl��HClO��HCl��HClO��̼���Ʒ�Ӧ�����Ȼ��ơ�̼�����ƺʹ������ƣ�
��5��0.01mol/L NaAlO2��Һ�м�������0.01mol/L NaHCO3��Һ���������ɫ��״�����������������ݲ���ȷ�����������������С��
��2����ͬ�¶��£����ǿ�������ǣ�CH3COOH��H2CO3��HClO��HCO3-���������ˮ��̶ȴ�С˳���ǣ�CO32-��ClO-��HCO3-��CH3COO-����ͬŨ�ȵ�������Һ�У��������ˮ��̶�Խ������Һ��pHԽ��
��3��ǿ���ܺ�������η�Ӧ�������
��4��������ˮ��Ӧ����HCl��HClO��HCl��HClO��̼���Ʒ�Ӧ�����Ȼ��ơ�̼�����ƺʹ������ƣ�
��5��0.01mol/L NaAlO2��Һ�м�������0.01mol/L NaHCO3��Һ���������ɫ��״�����������������ݲ���ȷ�����������������С��
���
�⣺��1����ͬ�¶��£���ĵ���ƽ�ⳣ��Խ��������Խǿ�����ݵ���ƽ�ⳣ��֪��������ǿ����CH3COOH���ʴ�Ϊ��CH3COOH��
��2����ͬ�¶��£����ǿ�������ǣ�CH3COOH��H2CO3��HClO��HCO3-���������ˮ��̶ȴ�С˳���ǣ�CO32-��ClO-��HCO3-��CH3COO-����ͬŨ�ȵ�������Һ�У��������ˮ��̶�Խ������Һ��pHԽ���������������ε�pH��С����˳���Ǣ٣��ۣ��ڣ��ʴ�Ϊ���٣��ۣ��ڣ�
��3�������ܺ�̼�����ƻ�̼���η�Ӧ������ɫ���壬����ǿ����ȡ����֪���������Դ���̼�ᣬ
�ʴ�Ϊ���ô�����Һ��̼�����ƣ�������̼���Σ���Ӧ������ɫ����������Ӷ�֤����������ǿ��̼�
��4��������ˮ��Ӧ����HCl��HClO��HCl��HClO��̼���Ʒ�Ӧ�����Ȼ��ơ�̼�����ƺʹ������ƣ���Ӧ����ʽΪ2Na2CO3+Cl2+H2O=2 NaHCO3+NaCl+NaClO��
�ʴ�Ϊ��2Na2CO3+Cl2+H2O=2 NaHCO3+NaCl+NaClO��
��5��0.01mol/L NaAlO2��Һ�м�������0.01mol/L NaHCO3��Һ���������ɫ��״����������������ƫ��������ӽ��������������������������AlO2-�������������ǿ���ʴ�Ϊ��AlO2-��
��2����ͬ�¶��£����ǿ�������ǣ�CH3COOH��H2CO3��HClO��HCO3-���������ˮ��̶ȴ�С˳���ǣ�CO32-��ClO-��HCO3-��CH3COO-����ͬŨ�ȵ�������Һ�У��������ˮ��̶�Խ������Һ��pHԽ���������������ε�pH��С����˳���Ǣ٣��ۣ��ڣ��ʴ�Ϊ���٣��ۣ��ڣ�
��3�������ܺ�̼�����ƻ�̼���η�Ӧ������ɫ���壬����ǿ����ȡ����֪���������Դ���̼�ᣬ
�ʴ�Ϊ���ô�����Һ��̼�����ƣ�������̼���Σ���Ӧ������ɫ����������Ӷ�֤����������ǿ��̼�
��4��������ˮ��Ӧ����HCl��HClO��HCl��HClO��̼���Ʒ�Ӧ�����Ȼ��ơ�̼�����ƺʹ������ƣ���Ӧ����ʽΪ2Na2CO3+Cl2+H2O=2 NaHCO3+NaCl+NaClO��
�ʴ�Ϊ��2Na2CO3+Cl2+H2O=2 NaHCO3+NaCl+NaClO��
��5��0.01mol/L NaAlO2��Һ�м�������0.01mol/L NaHCO3��Һ���������ɫ��״����������������ƫ��������ӽ��������������������������AlO2-�������������ǿ���ʴ�Ϊ��AlO2-��
���������⿼����������ʵĵ��뼰����ˮ�⣬��ȷ�������ƽ�ⳣ��������ǿ�����������ˮ��̶ȴ�С�Ĺ�ϵ�ǽⱾ��ؼ���ע�����������Խ���̼���̼���������֮�䣬���Դ������ܺ�̼���Ʒ�Ӧ��Ϊ�״��㣮

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
����˵����ȷ���ǣ�������
| A���ױ��л��������ı��ӿ��ü���Ũ��ˮ���˳�ȥ |
| B��ʵ�����������������Թ��м���1.5mLŨ�������μ���2mLŨ�����Ͼ��ȣ���ȴ��50�����£��ڲ������£���μ���1mL������ע�����ʹ�������¶ȳ���60�森���ϴ����ܵ���Ƥ����50�桫60��ˮԡ���� |
| C��CH4�к�������C2H4��ͨ����������KMnO4��Һ��ȥ |
| D�������ˮ���屽��ˮ�����������ˮ�����÷�Һ©������ |
��xR2++yH++O2=mR3++nH2O�����ӷ���ʽ�У���ϵ��m��R3+���ж���ȷ���ǣ�������
| A��m=4 R2+���������� |
| B��m=y R3+���������� |
| C��m=2 R3+�ǻ�ԭ���� |
| D��m=y R3+�ǻ�ԭ���� |

 ��ͼ��ʾ��A��B���ձ��о�ΪCuCl2��Һ�����������Ա�Ҫ�����Ӳ���գ�
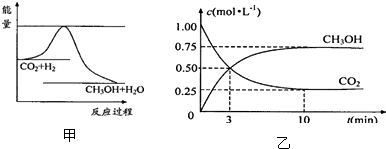
��ͼ��ʾ��A��B���ձ��о�ΪCuCl2��Һ�����������Ա�Ҫ�����Ӳ���գ� ʵ������67��ʱ��ij��Ӧ��ϵ��CCl4��Һ�и����ʵ�Ũ����ʱ��ı仯��ͼ����ش��������⣺
ʵ������67��ʱ��ij��Ӧ��ϵ��CCl4��Һ�и����ʵ�Ũ����ʱ��ı仯��ͼ����ش��������⣺