题目内容
在xR2++yH++O2=mR3++nH2O的离子方程式中,对系数m和R3+的判断正确的是( )
| A、m=4 R2+是氧化产物 |
| B、m=y R3+是氧化产物 |
| C、m=2 R3+是还原产物 |
| D、m=y R3+是还原产物 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:该反应中R元素化合价由+2价变为+3价、O元素化合价由0价变为-2价,根据原子守恒、电荷守恒确定n值,据此分析解答.
解答:
解:该反应中R元素化合价由+2价变为+3价、O元素化合价由0价变为-2价,所以R2+是还原剂、R3+是氧化产物,根据O原子守恒得n=2,根据H原子守恒得y=4,根据电荷守恒得2x+4=3m,根据R原子守恒得x=m,所以得m=4=y,故选B.
点评:本题考查了氧化还原反应,根据元素化合价变化结合电荷守恒、原子守恒确定各个字母的值,再结合基本概念分析解答.

练习册系列答案
相关题目
拆开1mol 共价键所吸收的能量或形成1mol 共价键所释放的能量称为键能.已知:H-H键能为436kJ/mol,H-N键能为391kJ/mol,N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,下列说法中正确的是( )
| A、H-H比N≡N更牢固 |
| B、N≡N键能约为946 kJ/mol |
| C、合成氨反应选择适当的催化剂是为了提高H2的转化率 |
| D、0.5mol N2和1.5mol H2在题给条件下充分反应,放出热量为46.2 kJ |
下列反应的离子方程式正确的是( )
A、实验室用NH4Cl和Ca(OH)2固体混合加热制NH3:NH
| ||||||
B、NaOH与NH4Cl溶液混合加热:NH
| ||||||
C、氨水加入盐酸中:NH3?H2O+H+═NH
| ||||||
| D、氨气通入稀H2SO4中:NH3+H+═NH4+ |
体积相同、物质的量浓度相同的HCl溶液和CH3COOH溶液分别与NaOH溶液中和时两者消耗的NaOH的物质的量( )
| A、相同 |
| B、中和CH3COOH的多 |
| C、中和HCl的多 |
| D、无法比较 |
在恒容的各个密闭容器中,下列反应分别达到平衡后,有关说法正确的是( )
| A、2HI(g) H2?(g)+I2(g);△H>0,若降低温度,颜色加深,压强增大 |
| B、2NO2(g)?N2O4(g);△H<0,充入氩气,压强增大,红棕色变浅 |
| C、3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g);△H<0,加入铁后,Fe3O4将增加 |
| D、2SO2(g)+O2(g)?2SO3(g);△H<0,升温后,气体密度不变,平均相对分子质量减小 |
下列说法中正确的是( )
| A、基态锂原子的电子排布式是1s22p1 |
| B、离子晶体中可能含共价键 |
| C、熔点:Na2O>I2>SiO2 |
D、H2O2的电子式: |
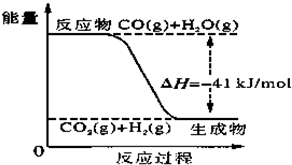 已知工业制氢气的反应为CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中能量变化如图所示.在500℃时的平衡常数K=9.若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1mol/L,10min时达到平衡状态.
已知工业制氢气的反应为CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中能量变化如图所示.在500℃时的平衡常数K=9.若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1mol/L,10min时达到平衡状态.