题目内容
pH相同、体积相同的盐酸和醋酸,分别与等物质的量浓度的氢氧化钠溶液恰好中和,消耗氢氧化钠溶液体积分别为Vl和V2,则Vl和V2的关系( )
| A、V1>V2 |
| B、V1<V2 |
| C、V1=V2 |
| D、V1≤V2 |
考点:酸碱混合时的定性判断及有关ph的计算,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:醋酸为弱酸,pH相等的盐酸和醋酸溶液,两种溶液中H+离子浓度相等,则醋酸浓度大于盐酸,
分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗的两种酸的物质的量相等,
根据n=cV比较二者的体积关系.
分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗的两种酸的物质的量相等,
根据n=cV比较二者的体积关系.
解答:
解:醋酸为弱酸,pH相等的盐酸和醋酸溶液,两种溶液中H+离子浓度相等,则醋酸浓度大与盐酸,
设盐酸的浓度为c1,醋酸的浓度为c2,则c1<c2,
分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗的两种酸的物质的量相等,
则有:n=c1V1=c2V2,
由于c1<c2,
所以:V1>V2.
故选A.
设盐酸的浓度为c1,醋酸的浓度为c2,则c1<c2,
分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗的两种酸的物质的量相等,
则有:n=c1V1=c2V2,
由于c1<c2,
所以:V1>V2.
故选A.
点评:本题考查酸碱混合的定性判断,题目难度中等,注意明确溶液pH与溶液中氢离子浓度的关系,本题中需要明确醋酸为弱电解质的特点.

练习册系列答案
相关题目
下列说法中正确的一组是( )
| A、正丁烷和异丁烷是同系物 |
| B、CH3CH2CH2CH(C2H5)CH3 和 C2H5CH(CH3)CH2CH2CH3是同一种物质 |
| C、H2和D2互为同位素 |
D、 和 和  互为同分异构体 互为同分异构体 |
下列离子方程式不正确的是( )
| A、氨气通入稀硫酸溶液中 NH3+H+=NH4+ |
| B、二氧化碳通入碳酸钠溶液中 CO2+CO32-+H2O=2 HCO3- |
| C、硫酸铝溶液跟偏铝酸钠溶液反应 Al3++3 AlO2-+6H2O=4Al(OH)3↓ |
| D、氯气通入冷的氢氧化钠溶液中 2Cl2+2OH-=3Cl-+ClO-+H2O |
在d轨道中电子排布成 ,而不排成
,而不排成 ,最直接的根据是( )
,最直接的根据是( )
 ,而不排成
,而不排成 ,最直接的根据是( )
,最直接的根据是( )| A、能量最低原理 |
| B、泡利原理 |
| C、构造原理示意图 |
| D、洪特规则 |
下列表示对应化学反应的离子方程式不正确的是( )
| A、Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| B、明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ |
| C、0.01mol?L-1 NH4Al(SO4)2溶液与0.02mol?L-1 Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3?H2O |
| D、二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-═SO42-+Cl-+H2O |
下列变化规律正确的是( )
| A、NaCl、MgCl2、MgO熔点由低到高 |
| B、H2O、H2S、H2Se的分解温度及沸点都由高到低 |
| C、O2、I2、Hg、NaCl、SiO2熔点由低到高 |
| D、碳化硅、单晶硅、金刚石、石墨熔点由低到高 |
水的电离平衡曲线如图所示,下列说法正确的是( )
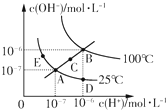

| A、图中五点KW间的关系:B>C>A=D=E |
| B、若从D点到A点,可采用在水中加入少量酸的方法 |
| C、若从A点到C点,可采用温度不变时在水中加入适量NaOH固体的方法 |
| D、若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性 |
 请按要求回答下列问题.
请按要求回答下列问题.