题目内容
水的电离平衡曲线如图所示,下列说法正确的是( )
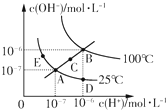

| A、图中五点KW间的关系:B>C>A=D=E |
| B、若从D点到A点,可采用在水中加入少量酸的方法 |
| C、若从A点到C点,可采用温度不变时在水中加入适量NaOH固体的方法 |
| D、若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性 |
考点:水的电离
专题:电离平衡与溶液的pH专题
分析:A.A、D、E都处于25℃时,Kw相等,然后比较B、C、E三点的c(H+)和c(OH-)的大小,依此比较Kw的大小;
B.从D点到A点c(H+)减小,c(OH-)增大,温度不变,Kw不变;
C.从A点到C点c(H+)和c(OH-)的变化判断Kw的变化,依次改变的条件;
D、根据B点时Kw计算酸与碱溶液中c(H+)和c(OH-),然后判断溶液的酸碱性.
B.从D点到A点c(H+)减小,c(OH-)增大,温度不变,Kw不变;
C.从A点到C点c(H+)和c(OH-)的变化判断Kw的变化,依次改变的条件;
D、根据B点时Kw计算酸与碱溶液中c(H+)和c(OH-),然后判断溶液的酸碱性.
解答:
解:A.ADE都处于25℃时,Kw相等,B点c(H+)和c(OH-)都大于E点的c(H+)和c(OH-),并且C点的c(H+)和c(OH-)大于A点c(H+)和c(OH-),c(H+)和c(OH-)越大,Kw越大,故B>C>A=D=E,故A正确;
B.加入酸,溶液中c(H+)变大,c(OH-)变小,而从D点到A点c(H+)减小,c(OH-)增大,故B错误;
C.若从A点到C点,c(H+)变大,c(OH-)变大,Kw增大,且c(H+)=c(OH-),溶液显示中性,无法通过加入氢氧化钠溶液实现,只能为升高温度,故C错误;
D.若处在B点时,Kw=1×10-12,pH=2的硫酸中c(H+)=10-2mol/L,pH=12的KOH中c(OH-)=1mol?L-1,等体积混合,氢氧根离子过量,溶液显进行,故D错误;
故选A.
B.加入酸,溶液中c(H+)变大,c(OH-)变小,而从D点到A点c(H+)减小,c(OH-)增大,故B错误;
C.若从A点到C点,c(H+)变大,c(OH-)变大,Kw增大,且c(H+)=c(OH-),溶液显示中性,无法通过加入氢氧化钠溶液实现,只能为升高温度,故C错误;
D.若处在B点时,Kw=1×10-12,pH=2的硫酸中c(H+)=10-2mol/L,pH=12的KOH中c(OH-)=1mol?L-1,等体积混合,氢氧根离子过量,溶液显进行,故D错误;
故选A.
点评:本题考查水的电离平衡移动问题,题目难度中等,结合图象判断并分析溶液在不同温度下的Kw,做题时注意根据图象比较c(H+)和c(OH-)的大小.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
某Na2SO3已部分氧化为Na2SO4,经测定该混合物含S的质量分数为25%,则含氧的质量分数为( )
| A、65% | B、39% |
| C、41% | D、无法确定 |
下列变化不可能通过一步实验直接完成的是( )
| A、SiO2→H2SiO3 |
| B、Al(OH)3→Al2O3 |
| C、SO2→H2SO4 |
| D、Fe→FeCl3 |
pH相同、体积相同的盐酸和醋酸,分别与等物质的量浓度的氢氧化钠溶液恰好中和,消耗氢氧化钠溶液体积分别为Vl和V2,则Vl和V2的关系( )
| A、V1>V2 |
| B、V1<V2 |
| C、V1=V2 |
| D、V1≤V2 |
关于元素周期表的说法正确的是( )
| A、第ⅠA族的元素都为金属元素 |
| B、第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| C、过渡元素全部是金属元素 |
| D、周期表中有7个主族,7个副族,一个0族,一个Ⅷ族,共16个族16个纵行 |


 有机物的结构可用“键线式”简化表示,如:CH3-CH=CH-CH3可表示为
有机物的结构可用“键线式”简化表示,如:CH3-CH=CH-CH3可表示为 ,有一种有机物X的键线式如图所示.
,有一种有机物X的键线式如图所示.