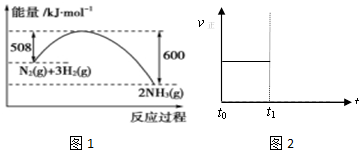
题目内容
5.浮选凝聚法处理酸性污水的工作原理如图所示,下列说法不正确的是( )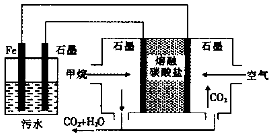
| A. | Fe电极的电极反应式为:Fe-2e-═Fe2+ | |
| B. | 通入空气的石墨电极的电极反应式为O2+2CO2+4e-═2CO32- | |
| C. | 通入甲烷的石墨电极的电极反应式为:CH4+100H+-8e-═CO32-+7H2O | |
| D. | 为增强污水的导电能力,可向污水中加入适量工业用食盐 |
分析 右边装置属于燃料电池,为原电池,通入甲烷的电极为负极,负极上甲烷失电子发生氧化反应,正极上氧气得电子发生还原反应,左边装置为电解池,铁作阳极,石墨作阴极,阴极上得电子发生还原反应,阳极上失电子发生氧化反应,据此分析解答.
解答 解:A.通入氧气的电极上得电子发生还原反应,所以通入氧气的电极为正极,则铁作阳极,阳极上铁失电子发生氧化反应,电极反应式为Fe-2e-═Fe2+,故A正确;
B.通入空气的电极为正极,正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+2CO2+4e-═2CO32-,故B正确;
C.通入甲烷的电极为负极,电极反应式为:CH4+4CO32--8e-═5CO2+2H2O,故C错误;
D.水是弱电解质,其导电能力较小,为了增强溶液的导电能力而加入强电解质工业用食盐,故D正确;
故选C.
点评 本题考查了原电池和电解池原理,明确各个电极上发生的电极反应是解本题关键,难点的电极反应式的书写,要结合电解质书写,难度中等.

练习册系列答案
相关题目
20.观察下列模型并结合有关信息,判断有关说法正确的是( )
| 硼晶体的结构单元 | SF6分子 | S8分子 | NaCl | |
| 结构模型示意图 |  | 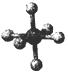 |  |  |
| 备注 | 熔点187K | 易溶于CS2 |
| A. | 单质硼属分子晶体,其结构单B12中含有30个B-B键,含20个正三角形 | |
| B. | SF6是由极性键构成的极性分子 | |
| C. | 固态硫S8属于原子晶体 | |
| D. | NaCl晶体中每个Na+周围距离最近的Na+有6个 |
10.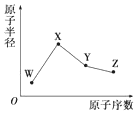 W、X、Y、Z是4种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和氖原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )
W、X、Y、Z是4种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和氖原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )
 W、X、Y、Z是4种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和氖原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )
W、X、Y、Z是4种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和氖原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )| A. | X的非金属性是同周期中最强的 | |
| B. | 对应气态氢化物的稳定性:Y>Z | |
| C. | 对应简单离子半径:X>W | |
| D. | Y的氧化物能与X的最高价氧化物对应的水化物反应 |
14.已知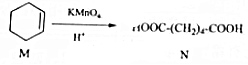 ,下列有关说法中正确的是( )
,下列有关说法中正确的是( )
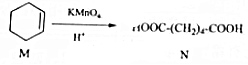 ,下列有关说法中正确的是( )
,下列有关说法中正确的是( )| A. | M中所有碳原子均位于同一平面,且与苯互为同系物 | |
| B. | 与N含有相同官能团的同分异构体共有8种 | |
| C. | M能发生加成反应和取代反应 | |
| D. | N与乙醇发生酯化反应,生成物的分子式一定为C8H14O4 |