题目内容
13.某课外活动小组,收集了一种合金进行探究.(1)外观暗灰色,表皮光滑;
(2)在酒精灯上灼烧,火焰绿色,合金片熔化,但不滴落;
(3)取刮去表皮的金属10.0g,放入足量H2SO4,收集到标准状况下的H2 8.96L;
(4)另取刮去表皮的金属10.0g,放入足量NaOH(aq)中,也收集到标准状况下的H2 8.96L.
试据此判断,合金中一定含有的元素是Cu、Al(写元素符号);下列元素可能含有的是a(填选项编号).
a.Ag b.Mg c.Na d.Fe
如果该合金中,只含2种元素,它们的质量比是m(Cu):m(Al)=1:4.
分析 焰色反应呈绿色,表明此合金中含有铜,相等质量的合金分别与H2SO4(aq)或NaOH(aq)反应,放出等体积的H2,表明该合金中含有金属铝,且不再含有比铜活泼的金属,否则与酸反应放出的H2多,故有可能含有Ag,根据关系式2Al~3H2↑来解答.
解答 解:焰色反应呈绿色,表明此合金中含有铜,相等质量的合金分别与H2SO4(aq)或NaOH(aq)反应,放出等体积的H2,表明该合金中含有金属铝,且不再含有比铜活泼的金属,否则与酸反应放出的H2多,故有可能含有Ag,根据关系式
2Al~3H2↑
54g 67.2L
m(Al) 9.96L
m(Al)=8.00g,则m(Cu)=10.0g-8.00g=2.00g
m(Cu):m(Al)=1:4
故答案为:Cu、Al;a;m(Cu):m(Al)=1:4.
点评 本题主要考查了元素及其化合物的性质,难度不大,注意铝具有两性,既可以与酸反应,也可以与碱反应.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
3.下列方案中,依照相应实验药品及图示装置进行实验,能达到相应实验目的是( )
| 方案 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |  |
| ① | 浓硝酸 | Na2S | AgCl溶液 | NaOH溶液 | |
| ② | 浓醋酸 | CaCO3 | NaOH溶液(过量) | Na2SiO3溶液 | |
| ③ | 浓盐酸 | KMnO4 | NaBr溶液 | KI溶液 | |
| ④ | 浓硫酸 | 蔗糖 | KMnO4溶液(过量) | 石灰水 |
| A. | 用①来验证溶解度:S(Ag2S)<S(AgCl) | |
| B. | 用②来验证酸性:CH3COOH>H2CO3>H2SiO3 | |
| C. | 用③来验证氧化性:KMnO4>Cl2>Br2>I2 | |
| D. | 用④来验证蔗糖与浓硫酸作用后有SO2和CO2产生 |
4.下列说法正确的是( )
| A. | 16gO2占有的体积约为11.2L | |
| B. | 22.4LH2含有阿伏加德罗常数个氢分子 | |
| C. | 在标准状况下,44.8LH2O的质量约为36g | |
| D. | 11gCO2与标准状况下5.6LHCl含有相同的分子数 |
18.将某文献资料上记载的相对原子质量数据摘录如表:
试回答下列问题:(1)34.969表示同位素35Cl相对原子质量 (2)35.485是表示氯元素的近似相对原子质量.
| 35Cl | 34.969 | 75.77% | 35Cl | 35 | 75.77% |
| 37Cl | 36.969 | 24.23% | 37Cl | 37 | 24.23% |
| 平均 | 35.453 | 平均 | 35.485 | ||
5.浮选凝聚法处理酸性污水的工作原理如图所示,下列说法不正确的是( )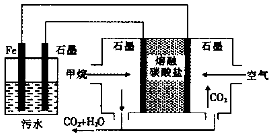

| A. | Fe电极的电极反应式为:Fe-2e-═Fe2+ | |
| B. | 通入空气的石墨电极的电极反应式为O2+2CO2+4e-═2CO32- | |
| C. | 通入甲烷的石墨电极的电极反应式为:CH4+100H+-8e-═CO32-+7H2O | |
| D. | 为增强污水的导电能力,可向污水中加入适量工业用食盐 |
2.25℃时,将某强酸和强碱溶液按10:1 的体积比混合后溶液恰好呈中性,则混合前强酸和强碱溶液的pH之和为( )
| A. | 9 | B. | ll | C. | 13 | D. | 15 |
13.某烯烃与H2加成后的产物为 ,则该烯烃的结构简式可能有( )
,则该烯烃的结构简式可能有( )
 ,则该烯烃的结构简式可能有( )
,则该烯烃的结构简式可能有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
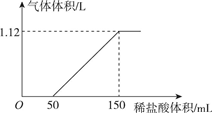 向某碳酸钠和碳酸氢钠的混合溶液中逐滴加入0.05mol/L的稀盐酸,加入稀盐酸体积与标准状况下产生气体体积的关系如图所示.
向某碳酸钠和碳酸氢钠的混合溶液中逐滴加入0.05mol/L的稀盐酸,加入稀盐酸体积与标准状况下产生气体体积的关系如图所示.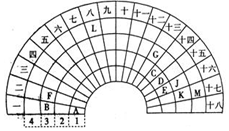 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(前四周期的元素),对比中学常见元素周期表,回答下列问题:
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(前四周期的元素),对比中学常见元素周期表,回答下列问题: .
. .
.