题目内容
12.下列有关物质性质的比较正确的是( )①同主族元素的单质从上到下,非金属性减弱,熔点增高
②所有元素的最高正化合价在数值上等于它所在的族序数
③同周期主族元素的原子半径越小,越难失去电子
④元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑤酸性:HClO4>H2SO4>H3PO4>H2SiO3.
| A. | ①③ | B. | ②④ | C. | ③⑤ | D. | ②⑤ |
分析 ①同主族元素的单质从上到下,非金属性减弱,但熔点可能降低;
②O、F无正价;
③同周期主族元素的原子半径越小,非金属性越强;
④元素的非金属性越强,对应氢化物越稳定,但氢化物水溶液的酸性不一定强;
⑤元素的非金属性越强,对应最高价含氧酸的酸性越强.
解答 解:①同主族元素的单质从上到下,非金属性减弱,但熔点可能降低,如碱金属单质的单质从上到下降低,故错误;
②O、F无正价,其它主族元素的最高正化合价在数值上等于它所在的族序数,故错误;
③同周期主族元素的原子半径越小,非金属性越强,则越难失去电子,故正确;
④元素的非金属性越强,对应氢化物越稳定,但氢化物水溶液的酸性不一定强,如HF最稳定,HF酸为弱酸,故错误;
⑤元素的非金属性越强,对应最高价含氧酸的酸性越强,则酸性:HClO4>H2SO4>H3PO4>H2SiO3,故正确;
故选C.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识及特例的应用,题目难度不大.

练习册系列答案
相关题目
3.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,11.2 L CCl4中含有的分子数为0.5NA | |
| B. | 在Na2O2与水的反应中,每生成1 mol O2,转移电子的数为2NA | |
| C. | 常温常压下,7.8 g苯中含有双键的数目为0.3NA | |
| D. | 25℃时,0.1 mol•L-1 NH4NO3溶液中含有的铵根离子数为0.1NA |
20.下列各组表达式意义相同的是( )
| A. | -NO2、NO2 | B. | -OH、 | C. | -COOH、HCOO- | D. | HCOOCH3、HOOCCH3 |
7.用如图装置测定水中氢、氧元素的质量比,方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H):m(O)>1:8.下列对导致这一结果的原因的分析中,不正确的是( )


| A. | Ⅰ、Ⅱ装置之间缺少干燥装置 | B. | Ⅱ装置中玻璃管内有水冷凝 | ||
| C. | Ⅱ装置中CuO没有全部被还原 | D. | Ⅲ装置后缺少干燥装置 |
17.下列说法正确的是( )
| A. | 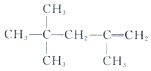 的名称为:2,2,4-三甲基-4-戊烯 的名称为:2,2,4-三甲基-4-戊烯 | |
| B. | 碳原子数小于或等于8的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃有6种 | |
| C. | 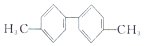 分子中至少有10个碳原子处于同一平面 分子中至少有10个碳原子处于同一平面 | |
| D. | 1 mol β-紫罗兰酮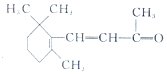 与1 mol H2发生加成反应可得到3种不同产物 与1 mol H2发生加成反应可得到3种不同产物 |
4.下列反应的离子方程式书写正确的是( )
| A. | 铜溶于FeCl3溶液:3Cu+2Fe3+═3Cu2++2Fe | |
| B. | 碳酸钙溶于醋酸:CO32-+2H+═CO2↑+H2O | |
| C. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | Ba(OH)2溶液中加入过量NaHCO3溶液:Ba2++HCO3-+OH-═BaCO3↓+H2O |
1.下列有关反应的离子方程式的书写,正确的是( )
| A. | 硫化钠的水解反应:S2-+H3O+═HS-+H2O | |
| B. | 等物质的量的溴化亚铁跟氯气反应:Fe2++2Br-+C12═Fe3++Br2+2Cl- | |
| C. | 向NaHSO3溶液中加人少量Ba(OH)2溶液:2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O | |
| D. | 将Fe2O3溶于氢碘酸中:Fe2O3+6H+═2Fe3++3H2O |
 .
. 某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.请回答:
某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.请回答: