题目内容
9.乙醛、丙醛组成的混合物中氢元素的质量分数为9%,则氧元素的质量分数( )| A. | 6% | B. | 16% | C. | 37% | D. | 不能确定 |
分析 在乙醛(CH3CHO)和丙醛(CH3CH2CHO)组成的混合物中,C、H两种元素的原子个数始终是1:2,故C、H两元素的质量之比=12:2=6:1,根据氢元素质量计算C元素的质量分数,根据ω(O)=1-ω(C)-ω(H)计算.
解答 解:在乙醛(CH3CHO)和丙醛(CH3CH2CHO)混合物中,碳原子与氢原子个数之比为1:2,则碳元素与氢元素的质量之比为12:2=6:1,混合物中氢元素质量分数为9%,则C元素的质量分数为9%×6=54%,故混合物中氧元素的质量分数为1-54%-9%=37%.
故选C.
点评 本题考查混合物中元素的质量分数的计算,关键是利用各组分的分子式确定C、H的固定组成,难度中等,侧重考查学生的思维能力.

练习册系列答案
相关题目
17.短周期主族元素W、R、M、X、Y、Z,原子序数依次增大.W、X、Y三种元素原子的最外层电子数之和为15,Y原子核电荷数等于W原子核电荷数的2倍,R原子最外层电子数与X原子最外层电子数相差2.下列叙述正确的是( )
| A. | W与R形成的化合物只能含离子键 | |
| B. | M、X与R的最高价氧化物的水化物所组成的原电池中M作负极 | |
| C. | 简单气态氢化物的沸点:Y<W | |
| D. | 化合物Y2Z2中只含极性共价键 |
4.下列各组物质互为同系物的是( )
| A. | 正戊烷和2-甲基丁烷 | B. | 甲苯和二甲苯 | ||
| C. | C6H5OH和C6H5CH2OH | D. | 甲醇和乙二醇 |
14.在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,则这种碳原子称为“手性碳原子”,凡有一个手性碳原子的物质一定具有光学活性,如图物质有光学活性,发生下列反应后生成的有机物仍有光学活性的是( )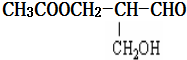
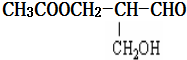
| A. | 与甲酸发生酯化反应 | B. | 与NaOH水溶液共热 | ||
| C. | 在铜作催化剂与氧气加热反应 | D. | 在催化剂存在下与氢气反应 |
1.已知${\;}_{58}^{140}$Ce是地壳中含量最高的稀土金属元素.下列关于${\;}_{58}^{140}$Ce的说法正确的是( )
| A. | 质量数为198 | B. | 中子数为82 | ||
| C. | 与${\;}_{58}^{142}$Ce为同素异形体 | D. | Ce元素相对原子质量为140 |
19.下列图示与对应的叙述不相符的是( )
| A. |  表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化 | |
| B. | 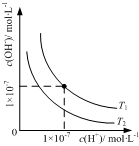 表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2<T1 | |
| C. | 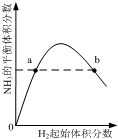 表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点 | |
| D. | 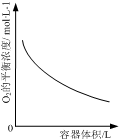 表示同一温度下,在不同容积的容器中进行反应2NO2(g)?2NO(g)+O2(g),O2的平衡浓度与容器容积的关系 |
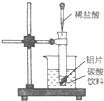 中.试回答下列问题:
中.试回答下列问题: