题目内容
19.某同学为了使金属和盐酸反应的热效应现象更利于观察,参加演示实验的效果,做了如图所示的改进:把试管小心地放入盛有(20℃)碳酸饮料的烧杯中,试管中开始放入几小片铝片,再用滴管滴加5毫升稀盐酸于试管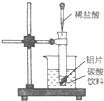 中.试回答下列问题:
中.试回答下列问题:(1)实验中观察到的现象是铝片上有大量气泡产生,铝片逐渐溶解;烧杯内液体放出气泡的速率加快.
(2)写出试管中有关反应的离子方程式2Al+6H+═2Al3++3H2↑.
(3)由实验推知,氯化铝溶液和氢气的总能量小于(选填“大于”、“小于”或“等于”)铝片和盐酸的总能量.
分析 金属与酸的置换反应是放热反应,使CO2溶解度减小,从而产生上述现象.根据反应的热效应与化学键的关系可知,放热反应中生成物的总能量小于反应物的总能量.
解答 解:(1)铝与氢氧化钠溶液反应生成氢气并放出热量,溶液温度升高导致二氧化碳的溶解度减小,产生气体的速度加快,故答案为:铝片上有大量气泡产生,铝片逐渐溶解;烧杯内液体放出气泡的速率加快;
(2)铝与盐酸反应生成氢气和氯化铝,反应的离子方程式为:2Al+6H+═2Al3++3H2↑,故答案为:2Al+6H+═2Al3++3H2↑;
(3)反应放热说明生成物能量和小于反应物能量和,故答案为:小于.
点评 本题考查铝与盐酸溶液的反应,该反应为放热反应,难度不大.要注意气体的溶解度随温度升高而减小.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.C4H8Cl2共有几种同分异构体( )
| A. | 6 | B. | 8 | C. | 9 | D. | 10 |
10.1,5-戊二醛(简称GA)是一种重要的饱和直链二元醛,2%的GA溶液对禽流感、口蹄疫等疾病有良好的防治作用.下列说法正确的是( )
| A. | 戊二醛的分子式为C5H8O2,符合此分子式的二元醛有5种 | |
| B. | 1 mol戊二醛与足量的银氨溶液反应,最多可得 2 mol银 | |
| C. | 戊二醛不能使酸性高锰酸钾溶液褪色 | |
| D. | 戊二醛经催化氧化可以得到4种戊二酸 |
14.下列说法正确的是( )
| A. | 二次电池的放电与充电属于可逆反应 | |
| B. | 碱金属单质在空气中燃烧都生成过氧化物 | |
| C. | 在周期表中,族序数都等于该族元素的最外层电子数 | |
| D. | 在周期表过渡元素中寻找催化剂恒和耐腐蚀、耐高温的合金材料 |
4.分子式为C5H12O的醇A,它含有-CH2OH结构的同分异构体有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
8.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ•mol-1氢气的燃烧热为241.8 kJ•mol-1 | |
| B. | 已知NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4 kJ•mol-1,则含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ/mol的热量 | |
| C. | 已知C(石墨,s)=C(金刚石,s);△H>0 则石墨比金刚石稳定 | |
| D. | 己知C(s)+O2(g)=CO2(g);△H1C(s)+1/2O2(g)=CO(g);△H2,则△H1>△H2 |
9.乙醛、丙醛组成的混合物中氢元素的质量分数为9%,则氧元素的质量分数( )
| A. | 6% | B. | 16% | C. | 37% | D. | 不能确定 |
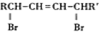 (R、R′表示烃基)
(R、R′表示烃基) (其中R1~R2表示氢或烃基)
(其中R1~R2表示氢或烃基) .
. .
. (其中任一种).
(其中任一种).