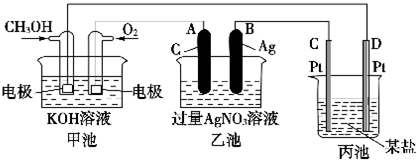
题目内容
16. t℃时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
t℃时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.| t/min | X/mol | Y/mol | Z/mol |
| 0 | 2.00 | 4.00 | 0 |
| 1 | 1.80 | 3.60 | 0.40 |
| 3 | 1.65 | 3.30 | 0.70 |
| 5 | 1.55 | 3.10 | 0.90 |
| 14 | 1.00 | 2.00 | 2.00 |
| 16 | 1.00 | 2.00 | 2.00 |
| 20 | 0.50 | 4.24 | 3.00 |
| 22 | 0.50 | 4.24 | 3.00 |
(2)计算该反应在0-3min时间内产物Z的平均反应速率:0.117mol/L•min,
(3)容器内混合气体的平均相对分子质量比起始投料时增大,(填“增大”、“减小”或“不变”)
(4)16min后,改变的条件为加入Y3.24mol,(注明物质的量)
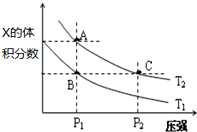
(5)在温度为T1、T2时,平衡体系中Z的体积分数随压强的变化如图所示,
①下列措施一定能增大该反应正反应速率的是ad,一定能使平衡向正反应方向移动的是cd.
a.升高温度 b.保持容器体积不变,充入惰性气体
c.分离出Z物质 d.缩小容器体积增大压强
②A和C点的正反应速率大小关系为vA<vC T2温度时,B点的正反应速率和逆反应速率大小关系为v正=v逆.
分析 (1)根据表中数据得到,反应进行到14min达到了平衡状态;
(2)该反应在0-3min时间内产物Z的平均反应速率v=$\frac{△c}{△t}$来计算;
(3)根据混合气体的平均相对分子质量M=$\frac{m}{n}$结合物质的量的变化来判断变化;
(4)根据16min后,X的物质的量减小,Z的物质的量增加,Y的物质的量也增加来判断改变的条件;
(5)①根据影响化学平衡移动和影响化学反应速率的因素来回答判断即可;
②根据两点上温度和压强关系来判断反应速率,根据温度的高低判断反应的移动方向即可.
解答 解:(1)由表中数据可知,X、Y为反应物,Z为生成物,1min时△n(X)=2mol-1.8mol=0.2mol,△n(Y)=4mol-3.6mol=0.4mol,△n(Z)=0.4mol,14min后各物质的物质的量不再变化,且反应物不为0,故为可逆反应,物质的量变化量之比等于化学计量数之比,故反应方程式为X+2Y?2Z,根据表中数据得到,反应进行到14min达到了平衡状态,t℃时该反应平衡常数的值为K=$\frac{2.0{0}^{2}}{1.00×2.0{0}^{2}}$=1,故答案为:1;
(2)该反应在0-3min时间内产物Z的平均反应速率v=$\frac{△c}{△t}$=$\frac{\frac{0.7mol}{2L}}{3min}$≈0.117mol/L•min;故答案为:0.117mol/L•min;
(3)根据混合气体的平均相对分子质量M=$\frac{m}{n}$,反应后混合气体的物质的量减小,质量守恒,所以容器内混合气体的平均相对分子质量比起始投料时增大了,故答案为:增大;
(4)16min后,到20min时,X的物质的量减小0.5mol,Z的物质的量增加1mol,所以Y的物质的量也会减小1mol,此时Y的物质的量是4.24mol,所以改变的条件是加入了Y,加入的物质的量是4.24mol-1mol=3.24mol,故答案为:加入Y3.24mol;
(5)①a.升高温度一定能增大该反应正反应速率,但是无法判断反应的移动方向;
b.保持容器体积不变,充入惰性气体,正反应速率不会变化,平衡不会移动;
c.分离出Z物质能减小该反应正反应速率,平衡正向移动;
d.缩小容器体积增大压强,一定能增大该反应正反应速率,平衡正向移动;故答案为:ad;cd;
②A和C点的温度一样,但是C点的压强大,所以正反应速率大小关系为vA<vC,T2温度时,B点的正反应速率和逆反应速率大小关系为v正=v逆,故答案为:<;=.
点评 本题考查化学平衡移动、外界条件对平衡的影响、化学平衡图象,反应速率、转化率的计算应用等,注意知识的迁移和应用是关键,难度中等.

| A. | B的氢化物和E的氢化物能相互反应,且得到的产物只含有共价键 | |
| B. | C在元素周期表中的位置是第三周期第ⅠA族 | |
| C. | 金属D能在A的最高价氧化物中燃烧,生成A的化合物 | |
| D. | E单质的水溶液使紫色石蕊试液先变红后褪色,说明E单质具有漂白性 |
| A. | 标准状况下,33.6LHF中含有氟原子的数目为1.5NA | |
| B. | 17g-OH中电子数为9NA | |
| C. | 氢氧燃料电池正极消耗22.4 L气体时,电路中通过的电子数目为2NA | |
| D. | 标准状况下,0.1mol Cl2溶于水,转移电子数为0.1NA |
| A. | 2H++2e-═H2 | B. | Fe-2e-═Fe2+ | ||
| C. | 2H2O+O2+4e-═4OH- | D. | Fe+2e-═Fe2+ |
| A. | 2个-CH3,能生成4种一氯代物 | B. | 3个-CH3,能生成4种一氯代物 | ||
| C. | 3个-CH3,能生成5种一氯代物 | D. | 4个-CH3,能生成4种一氯代物 |
| A. | 丁达尔现象是用于鉴别胶体与溶液的方法 | |
| B. | 豆浆制豆腐是利用了胶体聚沉的原理 | |
| C. | 通电时氢氧化铁胶体微粒向直流电源正极移动 | |
| D. | 分散质微粒直径介于1~100mm之间的分散系称为胶体 |
 回答问题
回答问题