题目内容
4.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 标准状况下,33.6LHF中含有氟原子的数目为1.5NA | |
| B. | 17g-OH中电子数为9NA | |
| C. | 氢氧燃料电池正极消耗22.4 L气体时,电路中通过的电子数目为2NA | |
| D. | 标准状况下,0.1mol Cl2溶于水,转移电子数为0.1NA |
分析 A.标况下氢氟酸为液体;
B.1个-OH含有9个电子;
C.气体状况未知;
D.氯气和水反应是可逆反应不能进行彻底;
解答 解:A.标况下氢氟酸为液体,不能使用气体摩尔体积,故A错误;
B.17g-OH物质的量为$\frac{17g}{17g/mol}$=1mol,含有电子数为9NA,故B正确;
C.气体状况未知,气体摩尔体积不确定,无法计算气体的物质的量,故C错误;
D.氯气和水反应是可逆反应不能进行彻底,常温常压下,0.1mol Cl2完全溶于水转移电子数小于0.1NA,故D错误;
故选:B.
点评 本题考查了有关阿伏伽德罗常数的应用,注意掌握标况下的气体摩尔体积的使用条件,熟练掌握物质的量与阿伏伽德罗常数、摩尔质量、物质的量浓度之间的关系,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.将一定量的Na2O2和NaHCO3混合后,在密闭容器中加热充分反应,排出气体,冷却后有固体物质剩余,下列选项不正确的是( )
| Na2O2/mol | NaHCO3/mol | 剩余固体成分 | |
| A | 1 | 2 | Na2CO3 |
| B | 1.5 | 2 | Na2O2Na2CO3 |
| C | 2 | 1 | Na2CO3、NaOH、Na2O2 |
| D | 2 | 2 | NaOH、Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
19.下列有关化学反应原理的叙述中,不正确的是( )
| A. | 常温pH=3的硫酸与pH=11的LiOH溶液等体积混合溶液呈碱性,说明LiOH为强碱 | |
| B. | 用明矾净水是因为Al3+水解生成的Al(OH)3胶粒能凝聚水中的悬浮物 | |
| C. | 除去MgCl2溶液中的FeCl3,可向其中加入MgCO3 | |
| D. | 除去锅炉水垢中的CaSO4,可加入Na2CO3溶液将其转化为CaCO3 |
9.下列离子方程式中不正确的是( )
| A. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 硫代硫酸钠与稀硫酸反应的离子方程式为S2O32-+2H+═SO42-+S↓+H2O | |
| C. | 利用水解原理制备纳米材料TiCl4+(2+n)H2O?4HCl+TiO2?nH2O↓ | |
| D. | 向明矾溶液中滴加Ba(OH)2至SO42-恰好完全沉淀时Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
16. t℃时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
t℃时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
(1)计算t℃时该反应平衡常数的值为K=1
(2)计算该反应在0-3min时间内产物Z的平均反应速率:0.117mol/L•min,
(3)容器内混合气体的平均相对分子质量比起始投料时增大,(填“增大”、“减小”或“不变”)
(4)16min后,改变的条件为加入Y3.24mol,(注明物质的量)
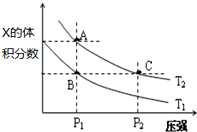
(5)在温度为T1、T2时,平衡体系中Z的体积分数随压强的变化如图所示,
①下列措施一定能增大该反应正反应速率的是ad,一定能使平衡向正反应方向移动的是cd.
a.升高温度 b.保持容器体积不变,充入惰性气体
c.分离出Z物质 d.缩小容器体积增大压强
②A和C点的正反应速率大小关系为vA<vC T2温度时,B点的正反应速率和逆反应速率大小关系为v正=v逆.
 t℃时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
t℃时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.| t/min | X/mol | Y/mol | Z/mol |
| 0 | 2.00 | 4.00 | 0 |
| 1 | 1.80 | 3.60 | 0.40 |
| 3 | 1.65 | 3.30 | 0.70 |
| 5 | 1.55 | 3.10 | 0.90 |
| 14 | 1.00 | 2.00 | 2.00 |
| 16 | 1.00 | 2.00 | 2.00 |
| 20 | 0.50 | 4.24 | 3.00 |
| 22 | 0.50 | 4.24 | 3.00 |
(2)计算该反应在0-3min时间内产物Z的平均反应速率:0.117mol/L•min,
(3)容器内混合气体的平均相对分子质量比起始投料时增大,(填“增大”、“减小”或“不变”)
(4)16min后,改变的条件为加入Y3.24mol,(注明物质的量)
(5)在温度为T1、T2时,平衡体系中Z的体积分数随压强的变化如图所示,
①下列措施一定能增大该反应正反应速率的是ad,一定能使平衡向正反应方向移动的是cd.
a.升高温度 b.保持容器体积不变,充入惰性气体
c.分离出Z物质 d.缩小容器体积增大压强
②A和C点的正反应速率大小关系为vA<vC T2温度时,B点的正反应速率和逆反应速率大小关系为v正=v逆.
13.下列说法中正确的是( )
| A. | 如果盐酸的浓度是醋酸的两倍,则盐酸中的H+浓度也是醋酸中的两倍 | |
| B. | 将NaOH溶液和氨水各稀释一份,两者的OH-浓度均减小到原来的$\frac{1}{2}$ | |
| C. | 中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸 | |
| D. | 若电解质溶液的导电能力也可能比强电解质溶液的强 |
1.设NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 1molCO2气体的质量为44g•mol-1 | |
| B. | 标准状况下,0.5mol水的体积为11.2L | |
| C. | 常温常压下,11.2 L氯气所含有的原子数目为NA | |
| D. | 同温同压下,相同物质的量的N2和CO所含的原子数相同 |
 实验室制取气体常用的装置如图所示,请回答下列问题.(选用装置时填字母编号)实验室通常用如图所示的装置来制取氨气.回答下列问题:
实验室制取气体常用的装置如图所示,请回答下列问题.(选用装置时填字母编号)实验室通常用如图所示的装置来制取氨气.回答下列问题: