题目内容
13.2010年4月14日7时49分在青海省玉树地区发生7.1级地震,造成了重大的人员伤亡和财产损失.为了保证震区的卫生环境,常使用漂白液和漂白粉对环境和饮用水进行杀菌、消毒,以抑制大规模传染病爆发.回答下列问题:
(1)漂白粉的有效成分是(填化学式)Ca(ClO)2;
(2)某研究性学习小组对漂白液进行了如下实验探究:取漂白液少量,滴入3~5滴紫色石蕊试液,发现溶液先变蓝色后褪色,可以证明漂白液具有的性质BC(填序号).
A.酸性 B.碱性 C.强氧化性 D.还原性
(3)工业上用氯气通入石灰乳[Ca(OH)2]制取漂白粉的化学方程式:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O.
(4)漂白粉露置在空气中变质的方程式:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO.
(5)二氧化氯是世卫组织确认的A级新型高效安全的消毒剂,其安全性远高于氯气.制备方法之一是:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O,氧化剂是NaClO3,还原剂是HCl,氧化产物与还原产物的物质的量之比1:2.
分析 (1)漂白粉的主要成分为氯化钙和Ca(ClO)2,次氯酸根离子具有强氧化性;
(2)发现溶液先变蓝色后褪色,说明溶液呈碱性,且具有强氧化性;
(3)氯气通入石灰乳,反应生成氯化钙和次氯酸钙;
(4)漂白粉露置在空气中变质,是次氯酸钙可与二氧化碳发生反应生成碳酸钙和次氯酸;
(5)NaClO3中氯氯元素化合价+5价变化为+4价,是氧化剂,HCl中氯元素化合价-1价变化为0价,是还原剂,而4mol盐酸中只有2mol被氧化.
解答 解:(1)漂白粉的主要成分为氯化钙和Ca(ClO)2,次氯酸根离子具有强氧化性,则Ca(ClO)2为有效成分,故答案为:Ca(ClO)2;
(2)发现溶液先变蓝色后褪色,说明溶液呈碱性,原因是次氯酸钙为强碱弱酸盐,水解呈碱性,水解生成的HClO具有强氧化性,具有漂白作用,故答案为:BC;
(3)氯气通入石灰乳,反应生成氯化钙和次氯酸钙,反应的方程式为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(4)漂白粉露置在空气中变质,是次氯酸钙可与二氧化碳发生反应生成碳酸钙和次氯酸,反应的化学方程式为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;
(5)NaClO3中氯氯元素化合价+5价变化为+4价,是氧化剂,HCl中氯元素化合价-1价变化为0价,是还原剂,而4mol盐酸中只有2mol被氧化,氧化产物与还原产物的物质的量之比为:1:2;故答案为:NaClO3;HCl;1:2.
点评 本题考查漂白粉的性质及制备,注意利用信息提供的反应物与生成物书写反应,侧重化学反应方程式及氧化还原反应的考查,题目难度不大.

 阅读快车系列答案
阅读快车系列答案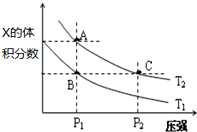 t℃时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
t℃时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.| t/min | X/mol | Y/mol | Z/mol |
| 0 | 2.00 | 4.00 | 0 |
| 1 | 1.80 | 3.60 | 0.40 |
| 3 | 1.65 | 3.30 | 0.70 |
| 5 | 1.55 | 3.10 | 0.90 |
| 14 | 1.00 | 2.00 | 2.00 |
| 16 | 1.00 | 2.00 | 2.00 |
| 20 | 0.50 | 4.24 | 3.00 |
| 22 | 0.50 | 4.24 | 3.00 |
(2)计算该反应在0-3min时间内产物Z的平均反应速率:0.117mol/L•min,
(3)容器内混合气体的平均相对分子质量比起始投料时增大,(填“增大”、“减小”或“不变”)
(4)16min后,改变的条件为加入Y3.24mol,(注明物质的量)
(5)在温度为T1、T2时,平衡体系中Z的体积分数随压强的变化如图所示,
①下列措施一定能增大该反应正反应速率的是ad,一定能使平衡向正反应方向移动的是cd.
a.升高温度 b.保持容器体积不变,充入惰性气体
c.分离出Z物质 d.缩小容器体积增大压强
②A和C点的正反应速率大小关系为vA<vC T2温度时,B点的正反应速率和逆反应速率大小关系为v正=v逆.
| A. | 2H2+O2$\frac{\underline{\;高温\;}}{\;}$2H2O | B. | CaO+CO2═CaCO3 | ||
| C. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | C2H5OH+3O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O |
| A. | 1molCO2气体的质量为44g•mol-1 | |
| B. | 标准状况下,0.5mol水的体积为11.2L | |
| C. | 常温常压下,11.2 L氯气所含有的原子数目为NA | |
| D. | 同温同压下,相同物质的量的N2和CO所含的原子数相同 |
| A. | X:3s23p1Y:3s23p5 | B. | X:3s2 Y:2s22p3 | ||
| C. | X:3s23p2 Y:2s22p4 | D. | X:3d64s2Y:2s22p4 |
| A. | 0.1mol铁在0.1mol氯气中燃烧,电子转移0.2NA个 | |
| B. | 标准状况下,2.24 L Cl2溶于水所得溶液中含有Cl_0.2 NA | |
| C. | 1.12 L氧气中含有0.1 NA个氧原子 | |
| D. | 1mol二氧化碳和足量的过氧化钠反应时转移电子数为2NA个 |
| A. | FeCl2 | B. | CuCl2 | C. | HCl | D. | FeCl3 |
| A. | Al3+、S2-、Na+、Cl- | B. | K+、Fe3+、S2-、OH- | ||
| C. | Ba2+、HCO3-、Fe3+、H+ | D. | Na+、Al3+、SO42-、NO3- |
 常温、常压下X2、Y2、Z2三种气体有如图转化关系:
常温、常压下X2、Y2、Z2三种气体有如图转化关系: