题目内容
10. 某学习小组同学为探究同周期或同主族元素性质的递变规律,设计了如下系列实验:
某学习小组同学为探究同周期或同主族元素性质的递变规律,设计了如下系列实验:Ⅰ.(1)将等质量的钾、钠、镁、铝分别投入到足量的同浓度的盐酸中,试预测实验结果:
上述金属中钾与盐酸反应最剧烈,铝与盐酸反应生成的气体最多.
(2)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明Cl的非金属性比S强.
反应的离子方程式为S2-+Cl2═S↓+2Cl-.
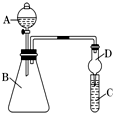
Ⅱ.利用如图装置来验证同主族元素非金属性的变化规律:
(1)要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液变蓝的现象,即可证明.干燥管D的作用是防止溶液倒吸.从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用NaOH溶液吸收尾气.
(2)要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,将观察到C中有白色沉淀生成的现象.但老师认为,该现象不足以证明酸性强弱关系为碳酸>硅酸,请用文字叙述理由从B中挥发出的HCl也会和硅酸钠溶液反应生成硅酸.
因此应在B、D之间增加一个盛有足量D(选填下列字母:A.浓盐酸 B.浓NaOH溶液C.饱和Na2CO3溶液 D.饱和NaHCO3溶液)的洗气装置.改进后C中发生反应的化学方程式是Na2SiO3+CO2+H2O═H2SiO3↓+Na2CO3(或Na2SiO3+2CO2+2H2O═H2SiO3↓+2NaHCO3.
分析 Ⅰ.(1)根据金属活动性顺序表可以判断钠、钾、镁、铝的活泼性,活泼性越强,与盐酸反应越剧烈;根据电子守恒比较生成氢气体积大小;
(2)硫离子被氯气氧化成硫单质,据此写出反应的离子方程式.
Ⅱ.(1)氯气能够将碘离子氧化成碘单质;球形干燥管具有防止倒吸的作用;氯气有毒,氯气能够与氢氧化钠溶液反应;
(2)盐酸酸性强于碳酸,二氧化碳能使石灰水变浑浊;盐酸挥发,应排除实验中干扰.
解答 解:Ⅰ.(1)金属活泼性顺序为:钾>钠>镁>铝,所以相同条件下与盐酸反应最激烈的是钾,反应速率最慢的是铝;生成1mol氢气需要得到2mol电子,1mol钾、钠都失去1mol电子,1mol镁失去2mol电子,而1mol铝失去3mol电子,所以生成氢气最多的是金属铝,
故答案为:钾;铝;
(2)氯气氧化性强于硫单质,所以氯气能够与硫离子反应生成硫,反应的离子方程式为:S2-+Cl2═S↓+2Cl-,
故答案为:S2-+Cl2═S↓+2Cl-;
Ⅱ.(1)浓盐酸和高锰酸钾反应生成氯气,氯气具有强氧化性,可与碘化钾反应生成碘,因淀粉遇碘变蓝色,则可观察到溶液变蓝,球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中,氯气有毒,不能排放到空气中,可与氢氧化钠溶液反应而被吸收,则可用氢氧化钠溶液进行尾气吸收,少量时,也可用石灰水吸收,
故答案为:变蓝;防止溶液倒吸;NaOH;
(2)因碳酸比硅酸强,二氧化碳可与硅酸钠反应生成硅酸沉淀,溶液变浑浊,从B中挥发出的HCl也会和硅酸钠溶液反应生成硅酸,氯化氢具有挥发性,干扰实验结果,需要将二氧化碳中的氯化氢除掉,根据氯化氢与碳酸氢钠反应,而二氧化碳不反应,可以在B和D之间增加装有饱和NaHCO3溶液的洗气瓶,改进后C中发生反应的化学方程式是Na2SiO3+CO2+H2O═H2SiO3↓+Na2CO3(或Na2SiO3+2CO2+2H2O═H2SiO3↓+2NaHCO3,
故答案为:有白色沉淀生成;从B中挥发出的HCl也会和硅酸钠溶液反应生成硅酸;D;Na2SiO3+CO2+H2O═H2SiO3↓+Na2CO3(或Na2SiO3+2CO2+2H2O═H2SiO3↓+2NaHCO3.
点评 本题考查了探究金属单质的金属性强弱、非金属单质的非金属性强弱方法,题目难度中等,正确掌握判断金属性、非金属性强弱的方法,明确除杂试剂的作用原则:除去装置,不能引进新的杂质.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 萃取 | B. | 蒸发灼烧 | C. | 用Fe置换 | D. | 电解 |
| A. | 纯碱和熟石灰都是碱 | |
| B. | 粗盐和酸雨都是混合物 | |
| C. | 盐酸和食醋既是化合物又是酸 | |
| D. | 生石灰与水混合的过程只发生物理变化 |
| A. | 氯碱工业的阳极反应式:2Cl--2e-═Cl2↑ | |
| B. | 钢铁吸氧腐蚀的正极反应式:O2+2H2O+4e-═4OH- | |
| C. | 碱性环境下氢氧燃料电池正极反应式:O2+2H2O+4e-═4OH- | |
| D. | 酸性环境下氢氧燃料电池负极反应式:H2-2e-+2OH-═2H2O |
| A. | 汽油与水不相溶,可以用裂化汽油萃取溴水中的溴 | |
| B. | 石油含有烷烃、环烷烃、芳香烃,煤含有苯、甲苯、二甲苯等有机物 | |
| C. | 煤的气化、液化是使煤变成清洁能源,减小环境污染的有效途径 | |
| D. | 沸点范围:汽油>煤油>柴油>重油 |
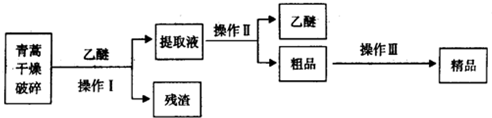
(1)对青蒿进行干燥破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸取率;
(2)操作I需要的玻璃仪器主要有:烧杯、漏斗、玻璃棒,操作Ⅱ的名称是蒸馏;
(3)操作Ⅲ的主要过程可能是B(填字母);
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算.
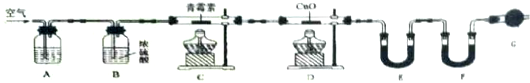
①装置A、E、F中盛放的物质分别是NaOH溶液、CaCl2或P2O5、碱石灰;
②G的作用是防止空气中的CO₂和水蒸气进入F的装置;
③
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
(5)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与C(填字母)具有相同的性质;
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如图所示:
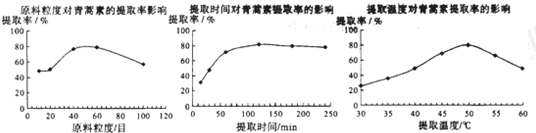
由上图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为B.
A.80目、100分钟、50℃B.60目、120分钟、50℃C.60目、120分钟、55℃
| A. | 并不是所有物质都含有化学键 | B. | 只有非金属原子间才能形成共价键 | ||
| C. | 单质不可能含有离子键 | D. | 共价化合物中不可能含有离子键 |
| A. | N5+离子中含有36个电子 | B. | O2与O4属于同位素 | ||
| C. | C60比金刚石熔点高 | D. | H2与H3属于同素异形体 |
