题目内容
20.第二次世界大战期间丹麦科学家玻尔被迫离开德军占领的祖国.为了表明一定要返回祖国的决心,他把心爱的金质诺贝尔奖章放在盛有“王水”(浓盐酸和浓硝酸的混合物)的玻璃容器中:Au+HNO3+3HCl═AuCl3+NO↑+2H2O.战后玻尔返回祖国,从溶液中提取出金,又重新铸造成奖章.下列方法中,不能从溶有金的王水中提取出金的是( )| A. | 萃取 | B. | 蒸发灼烧 | C. | 用Fe置换 | D. | 电解 |
分析 浓盐酸与浓硝酸按体积比1:3混合而成的溶液叫王水,它能溶解绝大多数金属,包括金、铂等极不活泼的金属.由题意,黄金溶于王水,实质上是发生了化学反应,Au以化合态形式存在于溶液中,且Au不溶于有机溶剂,因此肯定不能用萃取的方法提取金,以此解答该题.
解答 解:A.Au以化合态形式存在于溶液中,不能用萃取的方法分离,故A错误;
B.先蒸发水分后灼烧固体,可分解生成金,故B正确;
C.铁比金活泼,可置换出金,故C正确;
D.电解溶有黄金的王水,可在阴极上析出金,故D正确;
故选A.
点评 本题考查物质的分离和提纯以及金属的冶炼,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,题目难度不大.

练习册系列答案
相关题目
10.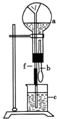 在图装置中,烧瓶中充满于燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是( )
在图装置中,烧瓶中充满于燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是( )
 在图装置中,烧瓶中充满于燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是( )
在图装置中,烧瓶中充满于燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是( )| a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 4mol/L NaOH溶液 |
| C | Cl2 | 饱和NaCl溶液 |
| D | NH3 | CCl4 |
| A. | A | B. | B | C. | C | D. | D |
11.毛巾、口罩要经常用开水蒸煮;被褥要放太阳光下直射,其目的是( )
| A. | 使蛋白质变性 | B. | 使油脂水解 | C. | 使氨基酸变性 | D. | 使多糖水解 |
8.LiH(氢化锂)常用作干燥剂、氢气发生剂等,可利用下列反应制备:2Li(熔融)+H2$\frac{\underline{\;\;△\;\;}}{\;}$2LiH.有关说法不正确的是( )
| A. | 微粒半径:r(H-)>r(H+) | B. | H-与Li+电子层结构相同 | ||
| C. | 还原性:H>Li | D. | 碱性:LiOH<NaOH |
12.CO和H2在一定条件下可以合成乙醇(CH3CH2OH):2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g),
下列叙述中能说明上述反应在一定条件下已达到化学平衡状态的是( )
下列叙述中能说明上述反应在一定条件下已达到化学平衡状态的是( )
| A. | CO在该条件下达到最大转化率 | |
| B. | 正反应和逆反应的化学反应速率均为零 | |
| C. | 反应容器中CO、H2和CH3CH2OH共存 | |
| D. | 反应体系中H2与CH3CH2OH 的物质的量浓度为4:1 |
9.下列有关化学用语使用正确的是( )
| A. | 次氯酸的结构式:H-Cl-O | B. | 乙烯的结构简式为:CH2CH2 | ||
| C. | CO2的比例模型: | D. | H2F+的电子式: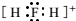 |
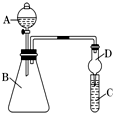 某学习小组同学为探究同周期或同主族元素性质的递变规律,设计了如下系列实验:
某学习小组同学为探究同周期或同主族元素性质的递变规律,设计了如下系列实验: