题目内容
18.草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产.一种制备草酸(含2个结晶水)的工艺流程如下:
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为CO+NaOH$\frac{\underline{\;200℃\;}}{2MPa}$HCOONa、2HCOONa$\stackrel{△}{→}$Na2C2O4+H2↑.
(2)该制备工艺中有两次过滤操作,过滤操作②的滤液是H2C2O4溶液和H2SO4溶液,滤渣是CaSO4.
(3)工艺过程中③和④的目的是分别循环利用氢氧化钠和硫酸能降低成本,减小污染.
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸.该方案的缺点是产品不纯,其中含有的杂质主要是Na2SO4.
(5)结晶水合草酸成品的纯度用高锰酸钾法测定.称量草酸成品0.250g溶于水,用0.050 0mol•L-1的酸性KMnO4溶液滴定,至浅粉红色不消褪,消耗KMnO4溶液15.00mL,反应的离子方程式为5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;列式计算该成品的纯度94.5%.
分析 根据流程图知,一定条件下,一氧化碳和氢氧化钠反应生成甲酸钠,反应方程式为:CO+NaOH$\frac{\underline{\;200℃\;}}{2MPa}$HCOONa,加热条件下,甲酸钠脱氢生成草酸钠,由原子守恒可知有氢气生成,反应方程式为:2HCOONa$\frac{\underline{\;\;△\;\;}}{\;}$Na2C2O4+H2↑.草酸钠与氢氧化钙反应得到草酸钙与氢氧化钠,滤液是NaOH溶液,浓缩后循环利用,固体为CaC2O4,草酸钙与硫酸反应得到硫酸钙与草酸钠,则滤渣为CaSO4,滤液B为草酸钠溶液,再经过结晶、干燥得到草酸钠晶体,母液中含有硫酸和草酸,可循环利用,
(1)根据反应物、生成物和反应条件写出反应方程式;
(2)草酸钙和稀硫酸反应生成草酸和硫酸钙,硫酸钙是微溶物;
(3)循环利用的物质能降低成本,减少污染;
(4)甲酸钠和硫酸反应生成硫酸钠,硫酸钠是可溶性物质;
(5)酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,根据草酸和高锰酸钾之间的关系式计算草酸的物质的量,再根据质量分数公式计算其纯度.
解答 解:(1)根据流程图知,200℃、2MPa条件下,一氧化碳和氢氧化钠反应生成甲酸钠,反应方程式为:CO+NaOH$\frac{\underline{\;200℃\;}}{2MPa}$HCOONa,加热条件下,甲酸钠脱氢生成草酸钠和氢气,反应方程式为:2HCOONa$\stackrel{△}{→}$Na2C2O4+H2↑,
故答案为:CO+NaOH$\frac{\underline{\;200℃\;}}{2MPa}$HCOONa,2HCOONa$\stackrel{△}{→}$Na2C2O4+H2↑;
(2)草酸钙和稀硫酸反应生成草酸和硫酸钙,硫酸钙是微溶物,该操作过程中,稀硫酸过量,所以过滤操作②的滤液是H2C2O4溶液、H2SO4溶液,滤渣是 CaSO4,
故答案为:NaOH溶液,CaC2O4 ,H2C2O4溶液、H2SO4溶液,CaSO4;
(3)氢氧化钠和硫酸都具有腐蚀性,能污染环境,分别循环利用氢氧化钠和硫酸能降低成本,减小污染,
故答案为:分别循环利用氢氧化钠和硫酸能降低成本,减小污染;
(4)甲酸钠和硫酸反应生成硫酸钠,硫酸钠是可溶性物质,存在于溶液中,所以含有的杂质主要是Na2SO4
,故答案为:Na2SO4;
(5)酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,离子反应方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,
设草酸的物质的量为xmol,则:
5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O
5mol 2mol
x 0.0500mol•L-1×0.015L
所以,5mol:2mol=x:0.0500mol•L-1×0.015L
解得x=0.001875mol,
故其纯度=$\frac{0.001875mol×126g/mol}{0.25g}$×100%=94.5%,
故答案为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;94.5%.
点评 本题考查了化学与技术,明确操作时发生的化学反应、常见的操作名称,难点是计算草酸结晶水合物的纯度,根据方程式进行分析解答,难度中等.

| A. | 微粒半径:r(H-)>r(H+) | B. | H-与Li+电子层结构相同 | ||
| C. | 还原性:H>Li | D. | 碱性:LiOH<NaOH |
| A. | 次氯酸的结构式:H-Cl-O | B. | 乙烯的结构简式为:CH2CH2 | ||
| C. | CO2的比例模型: | D. | H2F+的电子式: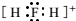 |
| A. | NaCl | B. | Cl2 | C. | HCl | D. | NaOH |
| A. | 漂白粉的主要成分为次氯酸钙 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 氯气泄漏时应喷洒盐酸处理毒气 | |
| D. | 实验室可用NaOH溶液处理SO2和HCl等废气 |
| A. | 12C和14C互为同位素,其中14C可用于文物的年代的鉴定 | |
| B. | 在元素周期表的金属和非金属分界线附近适合寻找半导体材料 | |
| C. | “青蒿一握,以水二升渍,绞取汁”,药学家屠呦呦对青蒿素的提取属于物理变化 | |
| D. | 煤、石油、天然气属于重要的可再生能源,而氢氧燃料电池则是一种能量转换率较高、符合绿色化学理念的新型动力电源 |
| A. | C4H8、C2H4 | B. | CH4、C2H5OH | C. | CH3COOH、C3H8 | D. | C2H6、C3H8 |
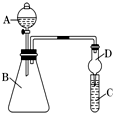 某学习小组同学为探究同周期或同主族元素性质的递变规律,设计了如下系列实验:
某学习小组同学为探究同周期或同主族元素性质的递变规律,设计了如下系列实验:
 ;
;