题目内容
5.下列叙述不正确的是( )| A. | 氯碱工业的阳极反应式:2Cl--2e-═Cl2↑ | |
| B. | 钢铁吸氧腐蚀的正极反应式:O2+2H2O+4e-═4OH- | |
| C. | 碱性环境下氢氧燃料电池正极反应式:O2+2H2O+4e-═4OH- | |
| D. | 酸性环境下氢氧燃料电池负极反应式:H2-2e-+2OH-═2H2O |
分析 A、用惰性电极电解饱和食盐水时,阳极上氯离子放电;
B、钢铁发生吸氧腐蚀时,正极上氧气得电子发生还原反应;
C、碱性环境下氢氧燃料电池正极上是氧气得电子的还原反应;
D、酸性环境下氢氧燃料电池负极上是氢气失电子的氧化反应.
解答 解:A、用惰性电极电解饱和食盐水时,阴极氢离子得电子产生氢气,阳极氯离子放电生成氯气,电极反应式为2Cl--2e-=Cl2↑,故A正确;
B、钢铁发生吸氧腐蚀时,正极上氧气得电子和水生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,故B正确;
C、碱性环境下氢氧燃料电池正极上是氧气得电子的还原反应,即O2+2H2O+4e-═4OH-,故C正确;
D、酸性环境下氢氧燃料电池负极上是氢气失电子的氧化反应:H2-2e-=2H+,故D错误.
故选D.
点评 本题考查了原电池和电解池原理,根据得失电子确定电极上发生的反应,难点是电极反应式的书写,难度不大.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
16.下列物质属于高分子化合物的是( )
| A. | 乙酸乙酯 | B. | 蔗糖 | C. | 乙醇 | D. | 蛋白质 |
13.下列有关Cl、N、S等非金属元素单质及其化合物的说法正确的是( )
| A. | 漂白粉的主要成分为次氯酸钙 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 氯气泄漏时应喷洒盐酸处理毒气 | |
| D. | 实验室可用NaOH溶液处理SO2和HCl等废气 |
20.下列指定反应的离子方程式正确的是( )
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | Na与水反应产生H2:Na+H2O═Na++OH-+H2↑ | |
| C. | 大理石与盐酸反应制取CO2:CO32-+2H+═CO2↑+H2O | |
| D. | 稀硫酸中滴加氢氧化钡溶液:SO42-+2H++2OH-+Ba2+═BaSO4↓+2H2O |
14.下列各项叙述中正确的是( )
| A. | 电负性的大小可以作为判断金属性和非金属性强弱的尺度 | |
| B. | 在同一电子层上运动的电子,其自旋方向肯定不同 | |
| C. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 | |
| D. | 原子最外层电子排布是5s1的元素,其氢氧化物一定不能溶解氢氧化铝 |
5.下列物质一定属于同系物的是( )
① ②
② ③
③ ④C2H4 ⑤C3H6⑥
④C2H4 ⑤C3H6⑥
①
 ②
② ③
③ ④C2H4 ⑤C3H6⑥
④C2H4 ⑤C3H6⑥
| A. | ①和② | B. | ④和⑤ | C. | ①和③ | D. | ④和⑥ |
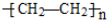
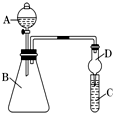 某学习小组同学为探究同周期或同主族元素性质的递变规律,设计了如下系列实验:
某学习小组同学为探究同周期或同主族元素性质的递变规律,设计了如下系列实验: