题目内容
9.随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示
根据判断出的元素回答问题:
(1)h在周期表中的位置是第3周期ⅦA族
(2)d、e、g常见离子半径由大到小的顺序(用化学式表示,下同):S2->O2->Na+
(3)f的最高价氧化物与e的最高价氧化物对应水化物反应的离子方程式Al2O3+2OH-+3H20=2[Al(OH)4]-
(4)z与x组成的4核18电子微粒的结构式为
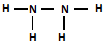
该微粒与空气形成一种碱性燃料电池,该电池放电时,负极反应为N2H4+4OH--4e-=4H2O+N2↑
(5)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1
(6)由上述八种元素中的四种组成的两种酸式盐发生反应的离子方程式:H++HSO3-=SO2↑+H2O
(7)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol•L-1R溶液的烧杯中滴加20ml 1.2mol•L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为0.022mol.
分析 从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)h是Cl元素,位于第3周期ⅤⅡA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大;
(3)f的最高价氧化物是Al2O3,e的最高价氧化物对应水化物是NaOH,二者反应生成Na[Al(OH)4];
(4)N和H组成的4核18电子微粒是N2H4,由共价键构成,在该碱性燃料电池放电时,负极上N2H4失去电子生成N2;
(5)钠在氧气中燃烧生成过氧化钠,反应方程式为:2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2,计算2mol钠反应放出放出的热量,注明物质的聚集状态与反应热书写热化学方程式;
(6)由上述八种元素中的四种组成的两种酸式盐能够发生反应,这两种酸式盐应为硫酸的酸式盐和亚硫酸的酸式盐;
(7)R是NH4Al(SO4)2,根据n=cV计算n(Al3+ )、n(NH4+)、n(SO42-)、n(Ba2+)、n(OH-),根据SO42-、Ba2+中不足量的离子的物质的量计算生成BaSO4的物质的量,依次发生:Al3++OH-=Al(OH)3↓、NH4++OH-=NH3•H2O、Al(OH)3+OH-=AlO2-+2H2O,根据方程式计算生成Al(OH)3的物质的量,进而二者计算生成沉淀总物质的量.
解答 解:从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)h是Cl元素,有三个电子层,最外层电子数为7,位于第3周期ⅤⅡA族,
故答案为:第3周期ⅦA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Na+,O2-和Na+2个电子层,而S2-3个电子层,所以S2-半径最大,
故答案为:S2->O2->Na+;
(3)f的最高价氧化物是Al2O3,e的最高价氧化物对应水化物是NaOH,二者反应生成Na[Al(OH)4],离子方程式为Al2O3+2OH-+3H20=2[Al(OH)4]-,
故答案为:Al2O3+2OH-+3H20=2[Al(OH)4]-;
(4)N和H组成的4核18电子微粒是N2H4,由共价键构成,结构式为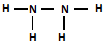 ,
,
N2H4与空气形成一种碱性燃料电池,该电池放电时,负极上N2H4失去电子生成N2,负极电极反应式为N2H4+4OH--4e-=4H2O+N2↑,
故答案为: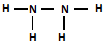 ;N2H4+4OH--4e-=4H2O+N2↑
;N2H4+4OH--4e-=4H2O+N2↑
(5)钠在氧气中燃烧生成过氧化钠,反应方程式为:2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2,2mol钠反应放出放出的热量为255.5kJ×2=511kJ,反应热化学方程式为:2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1,
故答案为:2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1.
(6)由上述八种元素中的四种组成的两种酸式盐能够发生反应,这两种酸式盐应为硫酸的酸式盐和亚硫酸的酸式盐,反应的离子方程式为H++HSO3-=SO2↑+H2O,
故答案为:H++HSO3-=SO2↑+H2O;
(7)10mL 1mol•L-1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,20mL 1.2 mol•L-1Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH-为0.048mol,
由SO42-+Ba2+=BaSO4↓,可知SO42-不足,故可以得到0.02mol BaSO4,
Al3++3OH-=Al(OH)3↓
0.01mol 0.03mol 0.01mol
反应剩余OH-为0.048mol-0.03mol=0.018mol,
NH4++OH-=NH3•H2O
0.01mol 0.01mol
反应剩余OH-为0.018mol-0.01mol=0.008mol,
Al(OH)3+OH-=AlO2-+2H2O
0.008mol 0.008mol
故得到Al(OH)3沉淀为0.01mol-0.008mol=0.002mol
则最终得到固体为0.02mol+0.002mol=0.022mol,
故答案为:0.022.
点评 本题考查结构位置性质关系、离子半径的大小比较、元素周期律、热化学方程式书写、离子浓度大小比较、化学反应方程式的化学计算,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.

| 选项 | 离子组 | X试剂 | 离子方程式 |
| A | K+、Na+、ClO-、SO42- | 少量SO2 | SO2+ClO-+H2O═SO42-+Cl-+2H+ |
| B | NH4+、Fe3+、Br-、SO42- | 过量H2S | 2Fe3++H2S═2Fe2++S↓+2H+ |
| C | NH4+、Na+、Fe3+、AlO2- | 过量铜粉 | 2Fe3++Cu═2Fe2++Cu2+ |
| D | K+、Na+、HCO3-、AlO2- | 少量HCl | H++AlO2-+H2O═Al(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
| A. | 在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移2NA个电子 | |
| B. | 10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% | |
| C. | 一定温度下,1molFeCl3水解生成NA个Fe(OH)3胶体颗粒 | |
| D. | 在标准状况下,2.24L苯中所含分子数约为NA |
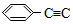 -CH=CH-CH3,有关其结构说法正确的是( )
-CH=CH-CH3,有关其结构说法正确的是( )| A. | 所有原子可能在同一平面上 | B. | 侧链所有碳原子可能共直线 | ||
| C. | 所有碳原子可能共面 | D. | 最多有18原子共面 |
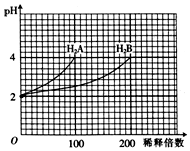 常温下,取pH=2的两种二元酸H2A和H2B各1mL,分别加水稀释,测得溶液pH与加水稀释倍数关系曲线如图所示,则下列叙述正确的是( )
常温下,取pH=2的两种二元酸H2A和H2B各1mL,分别加水稀释,测得溶液pH与加水稀释倍数关系曲线如图所示,则下列叙述正确的是( )| A. | H2A的电离方程式为H2A?H++HA-、HA-?H++A2- | |
| B. | pH=4的NaHA水溶液中:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-) | |
| C. | 含NaHA、NaHB的混合溶液中,各离子浓度关系为c(Na+)=c(A2-)+c(HB-)+c(H2B)+c(B2-) | |
| D. | NaHB水溶液中,各离子浓度的大小顺序为c(Na+)>c(HB-)>c(OH-)>c(H+)>c(B2-) |
| A. | 向FeCl3溶液中加入过量铁粉:Fe3++Fe═2Fe2+ | |
| B. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 向稀硫酸中加入 Ba(OH)2 溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+═H2SiO3↓+2Na+ |
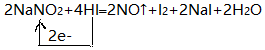 .
.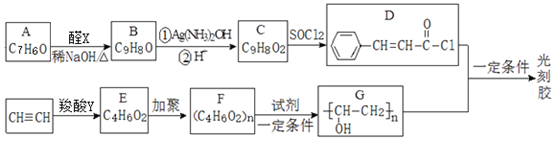
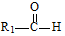 +
+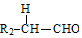 $→_{△}^{稀NaOH}$
$→_{△}^{稀NaOH}$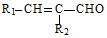 (R1,R2为烃基或氢)
(R1,R2为烃基或氢)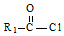 +R2OH$\stackrel{一定条件}{→}$
+R2OH$\stackrel{一定条件}{→}$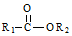 +HCl(R1,R2为烃基)
+HCl(R1,R2为烃基) .
. .
.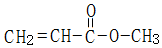
 .
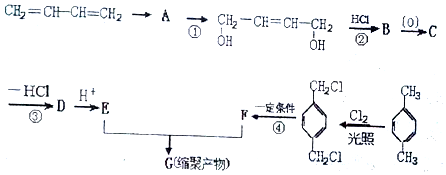
.
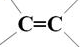 、-COOH.
、-COOH. .
.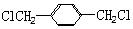 的同分异构体中含有苯环,且苯环上有三个取代基的同分异构体有16种.
的同分异构体中含有苯环,且苯环上有三个取代基的同分异构体有16种.