题目内容
18.在溶液中加入足量的过氧化钠后仍能大量共存的离子组是( )| A. | K+、AlO2-、Cl-、SO42- | B. | H+、Ba2+、Cl-、NO3- | ||
| C. | Ca2+、Fe2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、HSO32- |
分析 过氧化钠与水反应生成氢氧化钠和氧气,过氧化钠具有强氧化性,
A.四种离子之间不反应,加入过氧化钠后也不反应;
B.过氧化钠与水反应生成氢氧化钠,氢氧化钠与氢离子反应;
C.亚铁离子与碳酸氢根离子反应,过氧化钠能够氧化亚铁离子;
D.过氧化钠能够 氧化亚硫酸氢根离子.
解答 解:过氧化钠与水反应生成氢氧化钠和氧气,且过氧化钠具有强氧化性,
A.K+、AlO2-、Cl-、SO42-之间不发生反应,加入过氧化钠后也不反应,在溶液中能够大量共存,故A正确;
B.氢氧化钠能够与H+发生反应,加入过氧化钠后不能大量共存,故B错误;
C.Fe2+、HCO3-之间发生双水解反应,HCO3-与氢氧化钠反应,过氧化钠能够氧化Fe2+,在溶液中不能大量共存,故C错误;
D.过氧化钠能够氧化-,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等,试题培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.在一定温度下,某可逆反应aA(s)+bB(g)?cC(g)在一密闭的容器中达到平衡,如果t0时,改变某一外界条件,化学反应速率(v)-时间(t)图象如图所示.下列说法正确的是( )
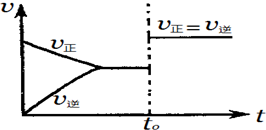

| A. | 若a+b=c,则t0时可能是增大反应体系的压强 | |
| B. | 若a+b=c,则t0时不可能是加入催化剂 | |
| C. | 若a+b≠c,则t0时只可能是加入催化剂 | |
| D. | 若a+b≠c,则t0时有可能是增大反应体系的压强 |
9.硅烷是一种无色、与空气反应并会引起窒息的气体.其分子结构和CH4相似,但Si-H键键能比C-H键键能低.下列判断错误的是( )
| A. | SiH4分子呈正四面体形 | |
| B. | SiH4分子是非极性分子 | |
| C. | 因为Si-H键键能比C-H键键能低,所以SiH4沸点低于CH4沸点 | |
| D. | SiH4分子稳定性低于CH4分子,因为C-H键键能高 |
13.广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果都是参与反应的物质和水分别离解成两部分,再重新组合新的物质.根据上述观点,下列说法不正确的是( )
| A. | PCl3的水解产物是PH3和HCl | B. | CuCl2的水解产物是Cu(OH)2和HCl | ||
| C. | NaClO的水解产物是HClO和NaOH | D. | CaO2的水解产物是Ca(OH)2和H2O2 |
3.某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生.下列化合物中符合上述条件的是( )
| A. | FeCl2 | B. | Na2O2 | C. | SO3 | D. | SiO2 |
10.在酸性溶液中能大量共存且为无色透明的溶液是( )
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Na+、NO3-、AlO2- | ||
| C. | K+、MnO4-、NH4+、NO3- | D. | Fe2+、K+、SO42-、NO3- |
7.NA 为阿伏加德罗常数,下列叙述正确的是( )
| A. | 22.4LCl2完全溶于水时转移的电子数为NA | |
| B. | 1 mol 甲基(-CH3)含有的电子数为9NA | |
| C. | 100g30%醋酸溶液中氢原子数为2NA | |
| D. | 100mL水中OH-的个数是10-8NA |
8.下列实验操作能够达到实验目的是( )
| A. | 从溴水中提纯单质溴的方法是:先用CCl4萃取,分液后再蒸馏 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 用盛NaOH溶液的洗气瓶除去CO2中混有的HCl气体 | |
| D. | 在实验室里,用澄清的石灰水和氯化铵溶液混合制取氨气 |