题目内容
8.15.6gNa2M中含有0.4molNa+,则:①该物质的摩尔质量为78g.mol-1,
②M的相对原子质量为32,
③该物质的化学式为Na2S.
分析 15.6gNa2X中含有0.4molNa+,根据Na2X的组成计算出Na2X的物质的量及摩尔质量,摩尔质量以g/mol为单位数值上等于其相对分子质量,依据Na2M相对分子质量计算M原子相对原子质量,确定该物质的化学式.
解答 解:15.6gNa2X中含有0.4molNa+,Na2X的物质的量为:n(Na2X)=$\frac{1}{2}$n(Na+)=0.4mol×$\frac{1}{2}$=0.2mol,
Na2X的摩尔质量为:M(Na2X)=$\frac{15.6g}{0.2mol}$=78g/mol,所以Na2X式量为78,M相对原子质量为:78-23×2=32,M质子数等于其中子数为16,M为S,则该物质的化学式为:Na2S;
故答案为:①78g.mol-1; ②32; ③Na2S.
点评 本题可查看了摩尔质量的简单计算,题目难度中等,注意摩尔质量与相对分子量的关系,试题侧重对学生分析问题解决问题能力的培养.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案
相关题目
4.关于几种分子中的化学键描述不正确的是( )
| A. | 苯每个碳原子的未参加杂化的 2p 轨道形成大π键 | |
| B. | CH4中的 4 个 C-H 键都是 H 的 1s 轨道与 C 的 2p 轨道形成的 s-pσ键 | |
| C. | C2H4 中,每个碳原子的 sp2 杂化轨道形成σ键、未杂化的2p 轨道形成π键 | |
| D. | 乙炔分子中,每个碳原子都有两个未杂化的 2p 轨道形成π键 |
17.在标准状况下,跟11.2L氨气中所含的氢原子数相同的下列物质是( )
| A. | 标准状况8.4LCH4 | B. | 0.3molHCl | C. | 98gH3PO4 | D. | 18gH2O |
18.某溶液中含如下离子组中的若干种:K+、Mg2+、Fe3+、Fe2+、Ag+、Cl-、CO32-、NO3-、SO42-、SiO32-、I-,且物质的量浓度相同.某同学欲探究该溶液的组成,进行如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钻玻璃,观察到紫色火焰
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成
Ⅲ.取Ⅱ反应后的溶液分置于两支试管中,第一支试管中加入BaC12溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层出现紫红色.下列说法正确的是( )
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钻玻璃,观察到紫色火焰
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成
Ⅲ.取Ⅱ反应后的溶液分置于两支试管中,第一支试管中加入BaC12溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层出现紫红色.下列说法正确的是( )
| A. | 原溶液中Fe2+和Fe3+至少有一种,一定没有SiO32-、Ag+ | |
| B. | 步骤Ⅱ中无色气体可能含有CO2,原溶液中可能含有CO32- | |
| C. | 原溶液中肯定含有Cl-、Mg2+ | |
| D. | 为确定是否含有Cl-,可取原溶液加入少量硝酸银和稀硝酸,观察是否产生沉淀 |
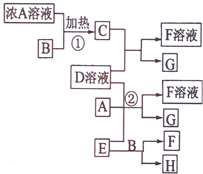 有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质,且受热易升华.实验室中,常用固体E在B的催化下加热制取气体单质H,H能使带火星的木条复燃.
有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质,且受热易升华.实验室中,常用固体E在B的催化下加热制取气体单质H,H能使带火星的木条复燃.