题目内容
有一在空气中暴露过的KOH固体,经分析知含水7.12%,K2CO32.88%,KOH 90%,若将此样品1g加入到46.00mL 1mol/L盐酸中,过量的酸再用1.07mol/LKOH溶液恰好中和,蒸发中和后的溶液可得固体( )g.
| A、6.07 | B、2.62 |
| C、4.54 | D、3.43 |
考点:化学方程式的有关计算
专题:计算题
分析:根据样品中的成分可知碳酸钾和氢氧化钾能与盐酸反应,将过量酸再用氢氧化钾中和时,反应后溶液中的溶质只有氯化钾,则可利用氯原子守恒来计算氯化钾的质量.
解答:
解:因样品中碳酸钾和氢氧化钾能与盐酸反应,过量酸用KOH溶液中和后溶液中的溶质只有氯化钾,
即蒸发中和后的溶液所得固体的质量为氯化钾的质量,设氯化钾的质量为xg,
由Cl原子守恒可得,
HCl~~~~~~~~~~~~KCl
1mol 74.5g
0.046L×1.00mol?L-1=0.046mol x1mol
解得x=
×74.5g≈3.43g.
故选:D.
即蒸发中和后的溶液所得固体的质量为氯化钾的质量,设氯化钾的质量为xg,
由Cl原子守恒可得,
HCl~~~~~~~~~~~~KCl
1mol 74.5g
0.046L×1.00mol?L-1=0.046mol x1mol
解得x=
| 0.046mol |
| 1mol |
故选:D.
点评:考查混合物的有关计算,关键清楚反应过程,利用原子守恒解答简化计算,注意守恒思想的运用.

练习册系列答案
相关题目
钠元素与硅元素最本质的区别是( )
| A、质子数不同 |
| B、相对原子质量不同 |
| C、中子数不同 |
| D、最外层电子数不同 |
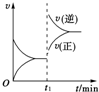 如图为某可逆反应的速率与时间的关系示意图,在t1时刻改变的条件为升温或增大压强,则该可逆反应可以是(提示:即升温或增大压强时均能符合如右图所示的速率与时间图象)( )
如图为某可逆反应的速率与时间的关系示意图,在t1时刻改变的条件为升温或增大压强,则该可逆反应可以是(提示:即升温或增大压强时均能符合如右图所示的速率与时间图象)( )| A、4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H<0 |
| B、2SO2(g)+O2(g)═2SO3(g)△H<0 |
| C、H2(g)+I2(g)═2HI(g)△H>0 |
| D、C(s)+H2O(g)═CO(g)+H2(g)△H>0 |
下列各组离子在溶液中能大量共存的是( )
| A、Na+、Al3+、NO3-、H+ |
| B、Ba2+、Na+、Cl-、SO42- |
| C、Mg2+、H+、SO42-、OH- |
| D、H+、Na+、CO32-、Cl- |
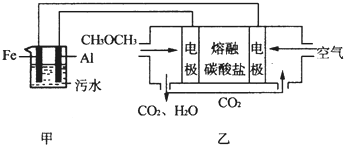
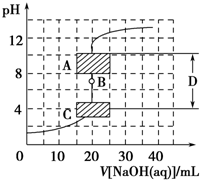 滴定法是中学化学中一种十分重要的定量分析方法.滴定法又可进一步分为酸碱中和滴定、氧化还原滴定等若干种.
滴定法是中学化学中一种十分重要的定量分析方法.滴定法又可进一步分为酸碱中和滴定、氧化还原滴定等若干种.