题目内容
9.活性ZnO俗称锌白,能改进玻璃的化学稳定性,可用于生产特种玻璃.由粗氧化锌(含ZnO、FeO、CuO等)制备ZnO,采取酸浸、净化除杂、中和沉淀、干燥等步骤,工艺如图: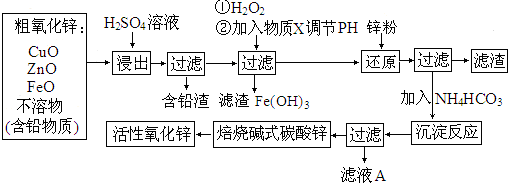
(1)为增大粗氧化锌的浸出率可以采取的措施有将粗氧化锌粉碎(加热、适当增大硫酸的浓度)(任写一条);
(2)该流程中物质X可以是下列中的ac;
A.ZnO B.NaOH C.Zn(OH)2 D.Na2CO3
(3)已知ZnO为两性氧化物,与氢氧化钠溶液反应可生成可溶性的锌酸盐(ZnO22-),写出反应的离子方程式ZnO+2OH-=ZnO22-+H2O;
(4)加入Zn后,过滤所得的滤渣中有Cu和Zn;
(5)上述流程中焙烧碱式碳酸锌用到的硅酸盐质仪器:坩埚、泥三角、酒精灯、玻璃棒;
(6)检验滤液A中溶质的阴离子的方法是取少量滤液A于试管中,加盐酸酸化,再滴加氯化钡溶液,若生成白色沉淀,则含有SO42-.
(7)取碱式碳酸锌水合物6.82g,溶于盐酸中生成二氧化碳448mL(标况下),溶解过程消耗氯化氢0.12摩尔,若该碱式盐中氢元素的物质的量为0.12mol,试推测该碱是碳酸锌水合物的化学式是ZnCO3•2Zn(OH)2•H2O(或Zn3(OH)4CO3•H2O).
分析 粗ZnO用硫酸溶解,CuO、FeO、Zn都和稀硫酸反应生成可溶性硫酸盐和水,然后过滤,滤去不溶性的含铅渣,滤液中含有FeSO4、CuSO4、ZnSO4,在滤液中加入H2O2,H2O2将Fe2+氧化成Fe3+,再调节pH值,使Fe3+生成Fe(OH)3沉淀,调节pH值时加入的物质既能与酸反应又要不引入新杂质,所以X可以为ZnO或Zn(OH)2等,调节溶液的pH,使Cu2+开始沉淀,向滤液中加入锌粉,与溶液中Cu2+和H+作用,过滤,向滤液中加入NH4HCO3使SO42-析出,最后得到碱式碳酸锌焙烧碱式碳酸锌得到活性ZnO,
(1)为增大粗氧化锌的浸出率可以采取的措施有改变温度、改变反应物接触面积、适当改变反应物浓度等;
(2)该流程中物质X要能和氢离子反应且不能引进新的杂质;
(3)ZnO为两性氧化物,与NaOH溶液反应可生成可溶性的锌酸盐(ZnO22-),根据氧化铝和NaOH的反应写出ZnO和氢氧化钠溶液反应的离子方程式;
(4)加入Zn后,Zn能置换出Cu,且Zn必须过量;
(5)上述流程中焙烧碱式碳酸锌用到的硅酸盐质仪器是坩埚、泥三角、酒精灯、玻璃棒;
(6)滤液A中溶质的阴离子是硫酸根离子,硫酸根离子用盐酸酸化的氯化钡溶液检验;
(7)依据元素守恒关系分别计算各微粒物质的量,其中物质组成的离子关系,反应的定量关系,质量关系计算得到判断出的各成分物质的量取最简整数比得到化学式.
解答 解:粗ZnO用硫酸溶解,CuO、FeO、Zn都和稀硫酸反应生成可溶性硫酸盐和水,然后过滤,滤去不溶性的含铅渣,滤液中含有FeSO4、CuSO4、ZnSO4,在滤液中加入H2O2,H2O2将Fe2+氧化成Fe3+,再调节pH值,使Fe3+生成Fe(OH)3沉淀,调节pH值时加入的物质既能与酸反应又要不引入新杂质,所以X可以为ZnO或Zn(OH)2等,调节溶液的pH,使Cu2+开始沉淀,向滤液中加入锌粉,与溶液中Cu2+和H+作用,过滤,向滤液中加入NH4HCO3使SO42-析出,最后得到碱式碳酸锌焙烧碱式碳酸锌得到活性ZnO,
(1)为增大粗氧化锌的浸出率可以采取的措施有改变温度、改变反应物接触面积、适当改变反应物浓度等,所以可以采用升高温度、增大硫酸浓度、将粗氧化锌粉碎等方法提高Zn的浸出率,
故答案为:将粗氧化锌粉碎(加热、适当增大硫酸的浓度);
(2)该流程中物质X要能和氢离子反应且不能引进新的杂质,通过以上分析知,ZnO和氢氧化锌都可以和氢离子反应且不引进新的杂质,故选ac;
(3)ZnO为两性氧化物,与NaOH溶液反应可生成可溶性的锌酸盐(ZnO22-),根据氧化铝和NaOH的反应写出ZnO和氢氧化钠溶液反应的离子方程式为ZnO+2OH-=ZnO22-+H2O,故答案为:ZnO+2OH-=ZnO22-+H2O
;
(4)加入Zn后,Zn能置换出Cu,且Zn必须过量,所以滤渣中成分是Cu和Zn,故答案为:Cu和Zn;
(5)上述流程中焙烧碱式碳酸锌用到的硅酸盐质仪器是坩埚、泥三角、酒精灯、玻璃棒,故答案为:坩埚、泥三角、酒精灯、玻璃棒;
(6)滤液A中溶质的阴离子是硫酸根离子,硫酸根离子用盐酸酸化的氯化钡溶液检验,其检验方法为取少量滤液A于试管中,加盐酸酸化,再滴加氯化钡溶液,若生成白色沉淀,则含有SO42-,
故答案为:取少量滤液A于试管中,加盐酸酸化,再滴加氯化钡溶液,若生成白色沉淀,则含有SO42-;
(7)n(CO32-)=n(CO2)=$\frac{0.448L}{22.4L/mol}$=0.02 mol;
n(Zn2+)=n(ZnCl2)=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$n(HCl)=0.06 mol;
根据电荷守恒得n(OH-)=2n(Zn2+)-2n(CO32-)=2×(0.06-0.02)=0.08 mol;
n(H2O)=[6.82g-m(Zn2+)-m(OH-)-m(CO32-)]÷18 g/mol=[6.82g-0.06mol×65g/mol-17g/mol×0.08mol-60g/mol×0.02mol]÷18g/mol=0.02 mol;
n(Zn2+):n(OH-):n(CO32-):n(H2O)=0.06:0.08:0.02:0.02=3:4:1:1:
化学式为:ZnCO3•2Zn(OH)2•H2O(或Zn3(OH)4CO3•H2O);
故答案为:ZnCO3•2Zn(OH)2•H2O(或Zn3(OH)4CO3•H2O).
点评 本题考查物质的分离和提纯,为高频考点,涉及复杂化学式的确定、离子方程式的书写、除杂、仪器的选择、离子检验等知识点,明确各个过程发生的反应及基本操作方法是解本题关键,难点是(7)题化学式的确定,题目难度中等.

| A. | 某物质的焰色呈黄色,说明该物质一定含有钠元素,不含钾元素 | |
| B. | 氧化钠和过氧化钠和酸均能反应生成盐和水,因此都是碱性氧化物 | |
| C. | 氧化钠和过氧化钠的阴阳离子比前者为1:2,后者为1:1 | |
| D. | 把过氧化钠投入滴有酚酞的水中,溶液先变红后褪色. |
| A. | 0.2mol•L-1的CH3COONa溶液中c(CH3COO-)=a mol•L-1,0.1mol•L-1的CH3COONa溶液中c(CH3COO-)=b mol•L-1,则有a=2b | |
| B. | 0.2mol•L-1的CH3COONa溶液与0.1mol•L-1的HCl溶液等体积混合,溶液显酸性:c(Na+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 相同物质的量浓度的下列溶液中,c(NH4+)由大到小的顺序:(NH4)2SO4>(NH4)2CO3>NH4Cl>NH4HCO3 | |
| D. | 0.1mol•L-1的HCN(弱酸)和0.1mol•L-1的NaCN等体积混合:c(HCN)+c(CN-)+c(OH-)═c(Na+)+c(H+) |
| A. | ①② | B. | ①②③ | C. | ①②③④ | D. | ②③④ |
| A. | MgCl2晶体 | B. | 熔融的KOH | C. | 液态HCl | D. | NaCl溶液 |
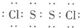 ,其晶体类型为分子晶体.
,其晶体类型为分子晶体.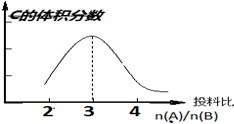 在恒温恒压条件下:aA(g)+bB(g)?2C(g),以不同的投料比开始反应,分别达到平衡时,C的体积分数与投料比的关系如图所示:
在恒温恒压条件下:aA(g)+bB(g)?2C(g),以不同的投料比开始反应,分别达到平衡时,C的体积分数与投料比的关系如图所示: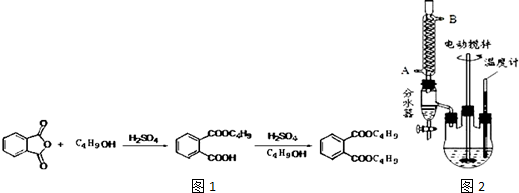
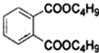 +2NaOH$\stackrel{加热}{→}$
+2NaOH$\stackrel{加热}{→}$ +2CH3CH2CH2CH2OH.
+2CH3CH2CH2CH2OH.