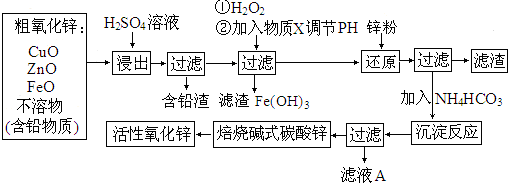
题目内容
17.常温下,下列离子浓度的关系正确的是( )| A. | 0.2mol•L-1的CH3COONa溶液中c(CH3COO-)=a mol•L-1,0.1mol•L-1的CH3COONa溶液中c(CH3COO-)=b mol•L-1,则有a=2b | |
| B. | 0.2mol•L-1的CH3COONa溶液与0.1mol•L-1的HCl溶液等体积混合,溶液显酸性:c(Na+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 相同物质的量浓度的下列溶液中,c(NH4+)由大到小的顺序:(NH4)2SO4>(NH4)2CO3>NH4Cl>NH4HCO3 | |
| D. | 0.1mol•L-1的HCN(弱酸)和0.1mol•L-1的NaCN等体积混合:c(HCN)+c(CN-)+c(OH-)═c(Na+)+c(H+) |
分析 A.根据醋酸钠的浓度越大,醋酸根离子的水解程度越小判断;
B.反应后溶质为等浓度的醋酸、醋酸钠和NaCl,混合液显示酸性,说明醋酸的电离程度大于醋酸根离子的水解程度,则醋酸根离子浓度增大:c(CH3COO-)>c(Cl-);
C.(NH4)2SO4>(NH4)2CO3的化学式中含有2个铵根离子,铵根离子的水解程度较小,则硫酸铵、碳酸铵溶液中的铵根离子浓度较大,再结合碳酸根离子、碳酸氢根离子水解促进了铵根离子的水解判断;
D.根据混合液中的电荷守恒判断.
解答 解:A.醋酸钠的浓度越大,醋酸根离子的水解程度越小,则溶液中醋酸根离子的浓度越大,所以a<2b,故A错误;
B.0.2mol•L-1的CH3COONa溶液与0.1mol•L-1的HCl溶液等体积混合,溶质为等浓度的醋酸、醋酸钠和NaCl,混合液显示酸性,说明醋酸的电离程度大于醋酸根离子的水解程度,则醋酸根离子浓度增大,所以c(CH3COO-)>c(Cl-),溶液中正确的浓度大小为:c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)>c(OH-),故B错误;
C.(NH4)2SO4>(NH4)2CO3的化学式含有2个铵根离子,由于水解程度较小,则硫酸铵、碳酸铵溶液中的铵根离子浓度较大,碳酸根离子、碳酸氢根离子水解促进了铵根离子的水解,则:(NH4)2SO4>(NH4)2CO3、NH4Cl>NH4HCO3,所以浓度相同时c(NH4+)由大到小的顺序为:(NH4)2SO4>(NH4)2CO3>NH4Cl>NH4HCO3,故C正确;
D.0.1mol•L-1的HCN(弱酸)和0.1mol•L-1的NaCN等体积混合,根据电荷守恒可得c(CN-)+c(OH-)=c(Na+)+c(H+),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

| A. | 泡沫灭火器中用的是硫酸铝和苏打溶液,并且苏打放在小塑料桶里. | |
| B. | 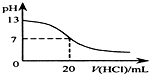 如图表示25℃时,用0.1mol•L-1盐酸滴定20mL0.1mol•L-1NaOH溶液,溶液的pH随加入酸体积的变化 | |
| C. | 在常温下用惰性电极电解足量食盐水的实验中,若电解后溶液总体积为0.5L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为14 | |
| D. | 常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) |
| 试剂 | 离子反应方程式 | |
| ①Fe(Al) | ||
| ②FeCl 2溶液(FeCl3) |
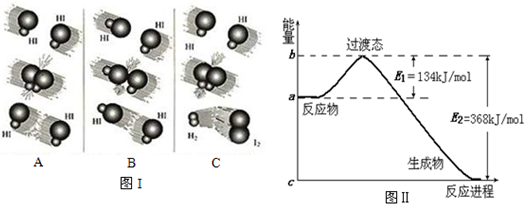
(1)图Ⅰ是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是C(选填“A”、“B”或“C”);
(2)图Ⅱ是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,则写出该反应的热化学方程式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ/mol
(3)E1的大小对该反应的反应热有无影响?无.(选填“有”或“无”)
(4)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1mol化学键时所需吸收的能量.如表是部分化学键的键能数据:
| 化学键 | C-H | Cl-Cl | C-Cl | H-Cl |
| 键能/kJ•mol-1 | X | 243 | 330 | 432 |
(5)已知:①C(s)+O2(g)═CO2(g);△H=-393.5kJ•mol-1
②2CO(g)+O2(g)═2CO2(g);△H=-566kJ•mol-1
③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g);△H=+141kJ•mol-1
则TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO(g)的△H=-80KJ/mol.
| A. | 跟水反应时,水作氧化剂 | |
| B. | NaH中阳离子半径大于阴离子半径 | |
| C. | 跟液氨反应时,生成氢气外,还生成铵盐 | |
| D. | 与乙醇反应时,放出氢气的速率比与水反应时更快 |
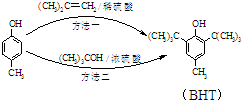 BHT是一种常用的食品抗氧化剂,从
BHT是一种常用的食品抗氧化剂,从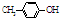 出发合成BHT的方法有如图两种.下列说法错误的是
出发合成BHT的方法有如图两种.下列说法错误的是(BHT)( )
| A. | BHT与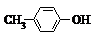 都能使酸性KMnO4褪色 都能使酸性KMnO4褪色 | |
| B. | BHT在水中的溶解度小于苯酚 | |
| C. | 两种方法的反应类型都是加成反应 | |
| D. | 从绿色化学角度分析方法一优于方法二 |
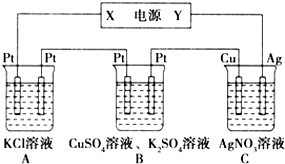 如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:
如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答: