题目内容
1.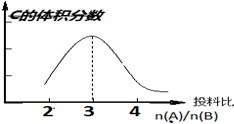 在恒温恒压条件下:aA(g)+bB(g)?2C(g),以不同的投料比开始反应,分别达到平衡时,C的体积分数与投料比的关系如图所示:
在恒温恒压条件下:aA(g)+bB(g)?2C(g),以不同的投料比开始反应,分别达到平衡时,C的体积分数与投料比的关系如图所示:(1)已知a、b均小于5的整数.由图示关系可知a、b分别为3、1.
(2)在300℃的条件下,向2L的恒容容器内加入4molA,2molB,达到平衡时C的体积分数为0.50.则该温度下的平衡常数为16 L2•mol-2.
(3)在上述温度下,向4L的恒容容器内加入6.5molA,3.5molB,1.0molC.达到平衡时A的体积分数为0.25 (或25%).
分析 (1)根据反应物投料之比等于计量数之比时,达到平衡时生成物的体积分数最大来回答;
(2)在300℃的条件下,向2L的恒容容器内加入4molA,2molB,设B的变化浓度是x,
3A(g)+B(g)?2C(g),
初始浓度:2 1 0
变化浓度:3x x 2x
平衡浓度:2-3x 1-x 2x
根据三行式结合平衡常数表达式来计算;
(3)4L的恒容容器内加入6.5molA,3.5molB,1.0molC达到平衡时与(2)中平衡等效,据此回答.
解答 解:(1)化学平衡中,反应物投料之比等于计量数之比时,达到平衡时生成物的体积分数最大,根据图示信息,反应物投料之比等于3:1,所以a=3,b=1,故答案为:3、1;
(2)在300℃的条件下,向2L的恒容容器内加入4molA,2molB,设B的变化浓度是x,
3A(g)+B(g)?2C(g),
初始浓度:2 1 0
变化浓度:3x x 2x
平衡浓度:2-3x 1-x 2x
$\frac{2x}{2-3x+1-x+2x}$=0.5,解得x=0.5,则该温度下的平衡常数为K=$\frac{1.{0}^{2}}{(1-0.5)(2-1.5)^{3}}$=16,故答案为:16;
(3)4L的恒容容器内加入6.5molA,3.5molB,1.0molC达到平衡时与(2)中平衡等效,达到平衡时A的体积分数为$\frac{2-3×0.5}{3-2×0.5}$×100%=25%,故答案为:25%.
点评 本题考查学生化学平衡的特点以及三行式的计算知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列物质中既能跟稀HCl反应,又能跟氢氧化钠溶液反应的是( )
①Al2O3 ②Al(OH)3 ③MgCl2 ④NaHCO3.
①Al2O3 ②Al(OH)3 ③MgCl2 ④NaHCO3.
| A. | ①② | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
16.甲烷和氨在国民经济中占有重要地位.
(1)制备合成氨原料气H2,可用甲烷蒸汽转化法,主要转化反应如下:
CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ/mol
CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=+165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去.工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法.此反应称为一氧化碳变换反应,该反应的热化学方程式是CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2 kJ/mol.
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+CO2 (g)?CO(NH2)2 (l)+H2O (l),该反应的平衡常数和温度关系如下:
①反应热△H(填“>”、“<”或“=”)<0.
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系.求图1中的B点处,NH3的平衡转化率32%.
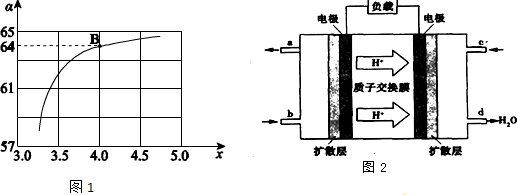
(3)已知甲烷燃料电池的工作原理如图2所示.该电池工作时,a口放出的物质为CO2,该电池正极的电极反应式为:O2+4e-+4H+=2H2O,工作一段时间后,当3.2g甲烷完全反应生成CO2时,有1.6mol 电子发生转移.
(1)制备合成氨原料气H2,可用甲烷蒸汽转化法,主要转化反应如下:
CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ/mol
CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=+165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去.工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法.此反应称为一氧化碳变换反应,该反应的热化学方程式是CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2 kJ/mol.
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+CO2 (g)?CO(NH2)2 (l)+H2O (l),该反应的平衡常数和温度关系如下:
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系.求图1中的B点处,NH3的平衡转化率32%.

(3)已知甲烷燃料电池的工作原理如图2所示.该电池工作时,a口放出的物质为CO2,该电池正极的电极反应式为:O2+4e-+4H+=2H2O,工作一段时间后,当3.2g甲烷完全反应生成CO2时,有1.6mol 电子发生转移.
6.NaH是一种离子化合物,与水反应时生成烧碱和氢气,它也能与乙醇,液氨等反应产生氢气.下列有关NaH的叙述正确的是( )
| A. | 跟水反应时,水作氧化剂 | |
| B. | NaH中阳离子半径大于阴离子半径 | |
| C. | 跟液氨反应时,生成氢气外,还生成铵盐 | |
| D. | 与乙醇反应时,放出氢气的速率比与水反应时更快 |
13.元素周期表中ⅣA元素包括C、Si、Ge、Sn、Pb等,已知Sn的+4价稳定,而Pb的+2价稳定.结合所学知识,判断下列反应中(反应条件略)正确的是( )
①Pb+2Cl2═PbCl4②Sn+2Cl2═SnCl4③SnCl2+Cl2═SnCl4
④PbO2+4HCl═PbCl4+2H2O⑤Pb3O4+8HCl═3PbCl2+Cl2↑+4H2O.
①Pb+2Cl2═PbCl4②Sn+2Cl2═SnCl4③SnCl2+Cl2═SnCl4
④PbO2+4HCl═PbCl4+2H2O⑤Pb3O4+8HCl═3PbCl2+Cl2↑+4H2O.
| A. | ②③⑤ | B. | ②③④ | C. | ①②③ | D. | ①②④⑤ |
10.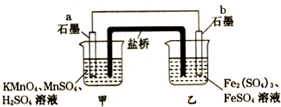 设计如图原电池(2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O),盐桥中装有饱和溶液.下列说法正确的是( )
设计如图原电池(2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O),盐桥中装有饱和溶液.下列说法正确的是( )
 设计如图原电池(2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O),盐桥中装有饱和溶液.下列说法正确的是( )
设计如图原电池(2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O),盐桥中装有饱和溶液.下列说法正确的是( )| A. | 外电路电子的流向是从a到b | |
| B. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| C. | a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O | |
| D. | 双液原电池工作时产生大量的热量 |
11.氨是最重要的化工产品之一.
(1)合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g)?CO(g)+3H2(g).有关化学反应的能量变化如图所示.CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1.
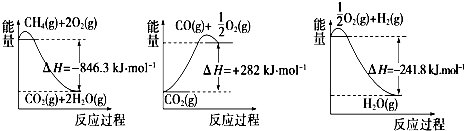
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l)△H<0.吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是B.(填字母)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)△H<0.某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%.该温度下此反应平衡常数K的值为2500 L2•mol-2.
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵.已知弱电解质在水中的电离平衡常数(25℃)如表:现有常温下0.1mol•L-1的(NH4)2CO3溶液,
①你认为该溶液呈碱(填“酸”、“中”或“碱”性).
②就该溶液中粒子之间有下列关系式,你认为其中不正确的是B.
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H3O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
(1)合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g)?CO(g)+3H2(g).有关化学反应的能量变化如图所示.CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1.

(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l)△H<0.吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是B.(填字母)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)△H<0.某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%.该温度下此反应平衡常数K的值为2500 L2•mol-2.
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵.已知弱电解质在水中的电离平衡常数(25℃)如表:现有常温下0.1mol•L-1的(NH4)2CO3溶液,
| 弱电解质 | H2CO3 | NH3•H2O |
| Ka1 | 4.30×10-7 | 1.77×10-5 |
| Ka2 | 5.61×10-11 |
②就该溶液中粒子之间有下列关系式,你认为其中不正确的是B.
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H3O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)