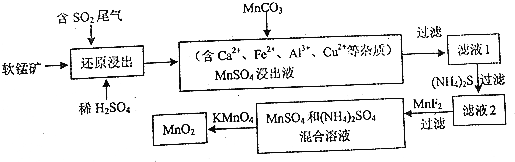
题目内容
20.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 1mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA | |
| B. | 11g分子式为C3H8的链烃中含有的C-H的数目为2NA | |
| C. | 室温时,1.0L pH=13的 Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | Fe与水蒸气反应生成22.4L氢气,转移的电子数为2NA |
分析 A、镁反应后变为+2价;
B、求出丙烷的物质的量,然后根据1mol丙烷中含8molC-H键来分析;
C、pH=13的氢氧化钡溶液中,氢氧根的浓度为0.1mol/L;
D、氢气所处的状态不明确.
解答 解:A、镁反应后变为+2价,故1mol镁反应后转移2NA个电子,故A错误;
B、11g丙烷的物质的量为0.25mol,而1mol丙烷中含8molC-H键,故0.25mol丙烷中含2NA条C-H键,故B正确;
C、pH=13的氢氧化钡溶液中,氢氧根的浓度为0.1mol/L,故1L溶液中氢氧根的物质的量为0.1NA个,故C错误;
D、氢气所处的状态不明确,故其物质的量无法计算,则转移的电子数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
10.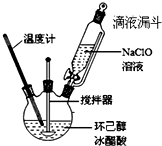 环己酮是重要的化工原料,也是重要的工业溶剂,实验室常用次氯酸氧化法制备环己酮.
环己酮是重要的化工原料,也是重要的工业溶剂,实验室常用次氯酸氧化法制备环己酮.
反应原理: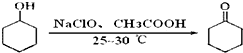
步骤:
①在如如图所示装置中,加入环己醇5.2mL(0.05mol)和冰醋酸33mL,开动电动搅拌器,将NaClO溶液缓慢滴加到反应液中,反应液温度保持在25~30℃,边加边反应,直至用KI淀粉试纸检验呈蓝色.
②一段时间后,反应液中加入足量饱和NaHSO3溶液,并将其转入250mL蒸馏烧瓶中,加入3g AlCl3和几粒沸石,摇匀.加热蒸馏至无油珠滴出为止.
③取馏出液,加入无水碳酸钠,至刚好呈碱性.继续搅拌,加入NaCl固体至不再溶解,分液取有机相.
④向有机相中加入无水硫酸镁,转入50mL蒸馏烧瓶中,馏取155.6℃左右的组分.得2.94g纯净的环己酮.
回答下列问题:
(1)该反应是放热反应,为防止温度过高可以采用的方法有控制滴加速度、冰水浴等.(任写一条)
(2)氧化法制备环己酮起氧化作用的是次氯酸,请写出NaClO和CH3COOH反应生成次氯酸的离子方程式:ClO-+CH3COOH=HClO+CH3COO-.
(3)加入饱和NaHSO3溶液的作用是除去过量的NaClO.加入NaCl固体的作用是减小环己酮的溶解度.分液时用到的玻璃仪器有分液漏斗、烧杯.
(4)蒸馏时加入AlCl3固体的作用是防起泡,加入沸石的作用是防止暴沸.上述实验中使用到滴液漏斗,相比于分液漏斗,它的优点是可以使漏斗内液体顺利流下.
(5)计算本实验的产率60%.
(6)第②步中,设计实验证明:加入的饱和NaHSO3溶液已经足量.取一段KI淀粉试纸于表面皿上,用玻璃棒蘸取反应液点试纸中央,若不变蓝,则NaHSO3溶液已足量.
 环己酮是重要的化工原料,也是重要的工业溶剂,实验室常用次氯酸氧化法制备环己酮.
环己酮是重要的化工原料,也是重要的工业溶剂,实验室常用次氯酸氧化法制备环己酮.反应原理:
| 物质 | 熔点(℃) | 沸点(℃) | 溶解性 |
| 环己醇 | 26 | 160.8 | 可溶于水 |
| 环己酮 | -45 | 155.6 | 微溶于水 |
| 冰醋酸 | 16.6 | 117.9 | 可溶于水 |
①在如如图所示装置中,加入环己醇5.2mL(0.05mol)和冰醋酸33mL,开动电动搅拌器,将NaClO溶液缓慢滴加到反应液中,反应液温度保持在25~30℃,边加边反应,直至用KI淀粉试纸检验呈蓝色.
②一段时间后,反应液中加入足量饱和NaHSO3溶液,并将其转入250mL蒸馏烧瓶中,加入3g AlCl3和几粒沸石,摇匀.加热蒸馏至无油珠滴出为止.
③取馏出液,加入无水碳酸钠,至刚好呈碱性.继续搅拌,加入NaCl固体至不再溶解,分液取有机相.
④向有机相中加入无水硫酸镁,转入50mL蒸馏烧瓶中,馏取155.6℃左右的组分.得2.94g纯净的环己酮.
回答下列问题:
(1)该反应是放热反应,为防止温度过高可以采用的方法有控制滴加速度、冰水浴等.(任写一条)
(2)氧化法制备环己酮起氧化作用的是次氯酸,请写出NaClO和CH3COOH反应生成次氯酸的离子方程式:ClO-+CH3COOH=HClO+CH3COO-.
(3)加入饱和NaHSO3溶液的作用是除去过量的NaClO.加入NaCl固体的作用是减小环己酮的溶解度.分液时用到的玻璃仪器有分液漏斗、烧杯.
(4)蒸馏时加入AlCl3固体的作用是防起泡,加入沸石的作用是防止暴沸.上述实验中使用到滴液漏斗,相比于分液漏斗,它的优点是可以使漏斗内液体顺利流下.
(5)计算本实验的产率60%.
(6)第②步中,设计实验证明:加入的饱和NaHSO3溶液已经足量.取一段KI淀粉试纸于表面皿上,用玻璃棒蘸取反应液点试纸中央,若不变蓝,则NaHSO3溶液已足量.
8.设NA代表阿佛加德罗常数的值,下列说法正确的是( )
| A. | 1molNH4Cl固体中共价键总数为5NA | |
| B. | 16gO2与O3的混合物中含有NA个氧原子 | |
| C. | 向装有催化剂的密闭容器加入3molH2和1molN2,充分反应后得2NA个氨分子 | |
| D. | 18g水(H2O)含有8NA个电子 |
15.下列有关化学键的叙述,不正确的是( )
| A. | 非金属元素构成的单质中一定存在共价键 | |
| B. | 由不同种原子间形成的共价键不一定是极性键 | |
| C. | 含有共价键的化合物不一定是共价化合物 | |
| D. | 化学键断裂,不一定发生化学变化 |
5.某有机物A用质谱仪测定示意图如图①,核磁共振氢谱示意图如图②,则A的结构简式可能为( )
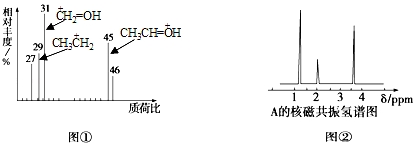

| A. | HCOOH | B. | CH3CHO | C. | CH3CH2OH | D. | CH3CH2COOH |
12.下列有关资源综合利用的说法不正确的是( )
| A. | 煤的气化、液化均为化学变化,而石油的常压蒸馏和减压蒸馏均是物理变化 | |
| B. | 绿色化学的核心就是利用化学原理吸收处理工业生产污染物并将其转化为有用物质 | |
| C. | 利用石油的裂化可以提高汽油的产量和质量 | |
| D. | 将苦卤水浓缩、氧化,鼓入空气和水蒸气可提取溴 |
9.某有机物蒸气、空气燃烧时需3倍于其体积的氧气,产生2倍于其体积的CO2,该有机物是( )
| A. | CH4 | B. | C2H6 | C. | C2H5OH | D. | CH3CHO |